光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)氯气工业上来源于氯碱工业,氯碱工业的化学方程式为
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO和H2,已知CH4、H2和CO的燃烧热(△H)分别为-890.3 kJ/mol、-285.8kJ/mol和-283.0 kJ/mol,则该反应的热化学方程式为:_____ _____;
(3)COCl2的分解反应为COCl2(g)  Cl2(g) + CO(g) △H =" +108" kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
Cl2(g) + CO(g) △H =" +108" kJ/mol。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10 min到14 min的COCl2浓度变化曲线来示出):
①计算反应在第8 min时的平衡常数K = __________(保留小数点后两位数字)
②比较第2 min反应温度T(2)与第8 min反应温度(T8)的高低:T(2)____T(8)(填“<”、 “>”或“=”);
③若12 min时反应于温度T(8)下重新达到平衡,则此时c(COCl2) = ______mol/L;
④比较产物CO在2~3 min、5~6 min和12~13 min时平均反应速率[平均反应速率分别以V(2—3)、 V(5—6)、 V(l2-13)表示]的大小____________;
⑤反应物COCl2在5-6 min和15-16 min时平均反应速率的大小为:V(5-6) > V(15-16),原因是__ _____________。
利用硫酸厂烧渣(含铁的氧化物和少量FeS及SiO2)制碱式硫酸铁的流程如下:
(1)SO2与过量NaOH溶液反应的离子方程式为 。
(2)滤渣的主要成分为 (填化学式)。
(3)反应1中加双氧水的目的是 。
(4)碱式硫酸铁的化学式为Fex(OH)y(SO4)z·nH2O,为确定其组成进行如下实验:
①称取1.6920 g 样品溶于足量的稀盐酸中;
②加足量的BaCl2溶液,过滤、洗涤、干燥、称重,得固体质量为2.3300 g;
③向步骤②的滤液中加过量的NaOH溶液,过滤、洗涤、灼烧、称重,得固体质量为0.6400 g。
根据以上实验数据计算碱式硫酸铁样品中的n(OH-): n(SO42-)(写出计算过程)
结合氯气的相关知识解决下列问题。
(1)在实验室中制取Cl2,下列收集Cl2的正确装置是 (填字母)。
将Cl2通入水中,所得溶液中具有氧化性的含氯粒子有 。
(2)氯气可用于生产漂白粉。由于盐酸浓度不同,漂白粉与盐酸混合发生反应的反应类型不同。
漂白粉与稀盐酸发生复分解反应,离子方程式为 。
漂白粉与浓盐酸发生氧化还原反应,离子方程式为 。
(3)某实验小组向100mL FeI2溶液中逐渐通入Cl2,会依次发生如下反应:
a.Cl2+2I-=2Cl-+I2
b.Cl2+2Fe2+=2Cl-+2Fe3+
c.5Cl2+I2+6H2O=10Cl-+2IO3-+12H+
其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示。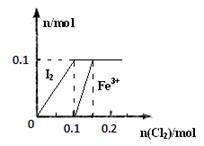
请回答下列问题:
①当n(Cl2)=0.12mol时,不考虑水的电离及金属离子的水解,分析溶液中所含金属阳离子及其
物质的量 (写出计算过程,否则不得分)。
②当溶液中n(Cl-):n(IO3-)=8:1时,通入的Cl2在标准状况下的体积为 L(写出计算过程,否则不得分)。
在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。
(1)化合物C的化学式为______________。
(2)物质I在生产生活中的用途有_______________(任答一条)。
(3)写出E+氧气→F的化学方程式:________________________。
(4)写出A与稀盐酸反应的离子方程式:____________________。
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸)。
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为 。
②多余的H2S气体可用 溶液来吸收,不能用燃烧的方法处理H2S气体的理由是 。
(2)用30% FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S = S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显 (填字母)。
a、不稳定性 b、弱酸性c、氧化性 d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是 。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则化学方程式为 。
(3)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示。
①表示H2的曲线是 (填“A”、“B”或“C”)。
②生成硫蒸气的分子式为 。
高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、 。
②配制过程中玻璃棒所起的作用是 。
③下列操作对实验结果的影响偏小的是 (填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:FeSO4 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
②实验时应测定的数据有:量取FeSO4溶液的体积和 。