某合作学习小组的同学利用下列氧化还原反应设计原电池:2KMnO4+10FeSO4+8H2SO4==2MnSO4+5Fe2(SO4)3+K2SO4+8H2O盐桥中装有饱和K2SO4溶液,下列叙述中正确的是
| A.乙烧杯中发生还原反应 |
| B.甲烧杯中溶液的pH逐渐减小 |
| C.电池工作时,盐桥中的SO42-移向甲烧杯 |
| D.外电路的电流方向是从a到b |
下列说法正确的是( )
| A.凡是放热反应都是自发的,由于吸热反应都是非自发的 |
| B.自发反应一定是熵增大,非自发反应一定是熵减少或不变 |
| C.自发反应在恰当条件下才能实现 |
| D.自发反应在任何条件下都能实现 |
一定条件下,体积为2L的密闭容器中,1mol X和3mol Y进行反应:X(g)+3Y(g)⇌2Z(g),经12s达到平衡,生成0.6mol Z.下列说法正确的是( )
A.以X浓度变化表示的反应速率为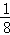 mol(L•s) mol(L•s) |
B.12s后将容器体积扩大为10L,Z的平衡浓度变为原来的 |
| C.若增大X的浓度,则物质Y的转化率减小 |
| D.若该反应的△H<0,升高温度,平衡常数K减小 |
恒温密闭容器中,某反应的化学反应速率随时间变化关系如图所示,下列说法不符合该图示的是( )
| A.达到平衡时,正逆反应速率相等 |
| B.增大反应物的浓度,反应由平衡I变化到平衡Ⅱ |
| C.反应达到平衡I以后,减小反应物浓度,平衡移动到Ⅱ |
| D.反应达到平衡II时的化学反应速率比平衡I时的大 |
一定温度下,可逆反应2NO2 2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
2NO+O2,在体积固定的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2,同时生成2n mol NO2;
②单位时间内生成n mol O2,同时生成2n mol NO;
③NO2、NO、O2的浓度比为2:2:1;
④混合气体的压强不再改变;
⑤混合气体的颜色不再改变;
⑥混合气体的平均摩尔质量不再改变.
| A.①④⑤⑥ | B.①②③⑤ | C.②③④⑥ | D.以上全部 |
把下列四种X溶液分别加入四个盛有10mL 2mol/L的盐酸的烧杯中,均加水稀释到50mL,此时X溶液和盐酸进行反应,其中反应速率最大的是( )
| A.10mL 4mol/L的X溶液 | B.30mL 2mol/L的X溶液 |
| C.3mL 10mol/L的X溶液 | D.15mL 3mol/L的X溶液 |