草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快。某学习小组结合化学反应原理提出猜想与假设,并设计了一系列实验进行探究。
实验Ⅰ:在2支试管中分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入少量MnSO4固体再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表1:
| 试 管 |
未加MnSO4的试管 |
加有MnSO4的试管 |
| 褪色时间 |
30 s |
2 s |
[表1]
实验Ⅱ:另取2支试管分别加入5 mL等浓度的H2C2O4溶液,在其中一支试管中先加入10滴稀硫酸,再各加入5滴0.1 mol·L-1 KMnO4溶液。记录溶液褪色时间,如表2:
| 试 管 |
未滴加稀硫酸的试管 |
滴加了稀硫酸的试管 |
| 褪色时间 |
100 s |
90 s |
[表2]
实验Ⅲ:另取3支试管分别加入5 mL等浓度H2C2O4溶液,然后在试管中先分别加入10滴、1 mL、2 mL稀硫酸溶液,再各加入5滴0.1 mol·L-1 KMnO4溶液,然后置于温度为65℃的水浴中加热。记录溶液褪色时间,如表3:
| 试 管 |
滴入10滴稀硫酸的试管 |
加入1 mL稀硫酸的试管 |
加入2 mL稀硫酸的试管 |
| 褪色时间 |
70 s |
100 s |
120 s |
[表3]
(1)实验Ⅰ得出的结论是_____。
(2)比较实验Ⅱ、Ⅲ得出的结论正确的是:_____。[来
①温度对该反应速率有影响
②硫酸对草酸和KMnO4溶液的反应有影响
③加入少量硫酸,可促进草酸和KMnO4溶液反应,而加入大量硫酸,反应速率比较小
④在酸性范围内,pH值越小对反应越有利[
(3)写出草酸溶液与酸性KMnO4溶液反应的离子方程式:____。实验室利用该反应标定未知浓度H2C2O4溶液,滴定终点的现象是:溶液颜色_____,且30 s不改变。滴定完成后仰视读取KMnO4溶液体积会导致测得H2C2O4溶液的浓度____(选填:偏大、偏小、无影响)。
(4)有同学根据查阅的资料提出KMnO4溶液氧化H2C2O4的反应历程为:
上述实验中,实验_____可证明这个历程是可信的。
辉铜矿(主要成分为Cu2S)经火法冶炼,可制得Cu和H2SO4,流程如下图所示:
(1)Cu2S中Cu元素的化合价是价。
(2)Ⅱ中,电解法精炼粗铜(含少量Ag、Fe),CuSO4溶液做电解质溶液:
①粗铜应与直流电源的极(填“正”或“负”)相连。
②铜在阴极析出,而铁以离子形式留在电解质溶液里的原因是。
(3)Ⅲ中,烟气(主要含SO2、CO2)在较高温度经下图所示方法脱除SO2,并制得H2SO4。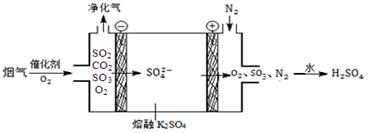
①在阴极放电的物质是。
②在阳极生成SO3的电极反应式是。
(4)检测烟气中SO2脱除率的步骤如下:
i.将一定量的净化气(不含SO3)通入足量NaOH溶液后,再加入足量溴水。
ii.加入浓盐酸,加热溶液至无色无气泡,再加入足量BaCl2溶液。
iii.过滤、洗涤、干燥,称量沉淀质量。
①用离子方程式表示i中溴水的主要作用。
②若沉淀的质量越大,说明SO2的脱除率越(填“高”或“低”)。
某同学分析Zn与稀H2SO4的反应。
(1)该反应的离子方程式是。
(2)制H2时,用稀硫酸而不用浓硫酸,原因是_________。
(3)已知:Zn(s)+1/2O2(g)=ZnO(s) △H=-332kJ/mol
ZnO(s) + H2SO4(aq) = ZnSO4(aq) + H2O(l) △H=-112kJ/mol
H2(g) +1/2 O2(g) = H2O(l) △H=-286kJ/mol
则Zn与稀H2SO4反应生成1mol H2时的反应热△H=kJ/mol。
(4)该同学用如下装置进行实验,分析影响反应速率的因素。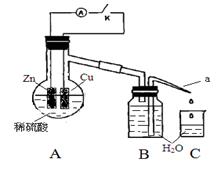
实验时,从断开K开始,每间隔1分钟,交替断开或闭合K,并连续计数每1 分钟内从a管流出的水滴数,得到的水滴数如下表所示:
| 1分钟水滴数(断开K) |
34 |
59 |
86 |
117 |
… |
102 |
| 1分钟水滴数(闭合K) |
58 |
81 |
112 |
139 |
… |
78 |
分析反应过程中的水滴数,请回答:
①由水滴数58>34、81>59,说明在反应初期,闭合K时比断开K时的反应速率______(填“快”或“慢”),主要原因是_________。
②由水滴数102>78,说明在反应后期,断开K时的反应速率快于闭合K时的反应速率,主要原因是_______。
③从能量转换形式不同的角度,分析水滴数86>81、117>112的主要原因是_______。
重晶石(BaSO4)是重要的化工原料,用重晶石制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下: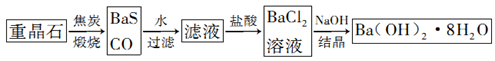
已知:Ba(s)+S(s)+2O2(g) BaSO4(s)ΔH="-1" 473.2 kJ·mol-1
BaSO4(s)ΔH="-1" 473.2 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH="-221" kJ·mol-1
2CO(g) ΔH="-221" kJ·mol-1
Ba(s)+S(s) BaS(s) ΔH="-460" kJ·mol-1
BaS(s) ΔH="-460" kJ·mol-1
(1)写出煅烧时发生反应的热化学方程式:。
(2)写出氢氧化钡晶体与氯化铵混合反应的化学方程式:。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀并产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+ CO32-(aq) BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因:。
草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
【提出假设】
假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是。
【设计、完成实验】
(1)称取g草酸晶体(H2C2O4·2H2O),配置500mL0.10mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和。
②下列操作会使所配溶液浓度偏低的是(填下列选项的字母序号)。
| A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
| B.定容时俯视刻度线 |
| C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
| D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
x =时,假设2成立。
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10mol/L H2C2O4溶液于锥形瓶中,加入10mL 0.50mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为。上述实验中KMnO4溶液的物质的量浓度为。
利用下图所示实验(部分装置)收集氯气并验证氯气的性质: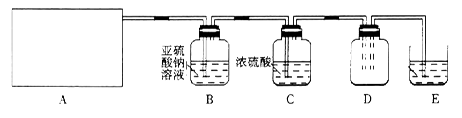
(1)A为Cl2的发生装置。若制取氯气的化学方程式为_________,与之对应的A装置是_______(填写装置的序号)。
(2)利用D中的广口瓶收集氯气,试在装置图中完善D装置(将虚线表示的一根或两根导管改为实线,也可都不改)。
(3)写出装置E中反应的离子方程式________________。
(4)利用D中收集的氯气进行铁与氯气的反应实验:用坩埚钳夹持一束细铁丝,______________,然后伸入盛有氯气的集气瓶中。
(5)通入氯气一段时间后,洗气瓶B溶液中有一部分S 氧化成
氧化成 ,反应的离子方程式为___________________。试设计实验方案,检验洗气瓶B溶液中Cl和
,反应的离子方程式为___________________。试设计实验方案,检验洗气瓶B溶液中Cl和 的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。
的存在。可供选择的试剂及仪器为:稀盐酸、稀硝酸、BaCl2溶液、Ba(NO3)2溶液、AgNO3溶液、澄清石灰水、试管、胶头滴管。