在1000K时,已知反应Ni(s)+H2O(g) NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应
NiO(s)+H2(g)的平衡常数K=0.0059。当水蒸气和氢气的物质的量浓度相等时,此反应
| A.已达平衡状态 | B.未达平衡状态,反应正向进行 |
| C.未达平衡状态,反应逆向进行 | D.无法确定 |
下列除杂(括号内为杂质)有关操作,其中正确的是()
| A.苯 (苯酚)—— 加入适量浓溴水,过滤 |
| B.(NO2)——通过水洗、干燥后,用向下排空气法收集 |
| C.乙烷 (乙烯)——让气体通过盛有酸性高锰酸钾溶液的洗气瓶 |
| D.乙醇 (乙酸)——加足量CaO固体,蒸馏 |
在人们的印象中,塑料是常见的绝缘材料,但2000年三名诺贝尔化学奖得主的研究成果表明,塑料经改造后能像金属一样具有导电性,要使塑料聚合物导电,其内部的碳原子之间必须交替地以单键和双键结合(再经掺杂处理)。目前导电聚合物已成为物理学家和化学家研究的重要领域.由上述分析,下列聚合物经掺杂处理后可以制成“导电塑料”的是()
某有机物的结构简式为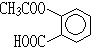 ,它可以发生的反应类型有()
,它可以发生的反应类型有()
①取代②加成③消去④酯化⑤水解⑥中和 ⑦缩聚⑧加聚
| A.只有①②④⑤ | B.只有①②④⑤⑥ |
| C.只有①②④⑤⑥⑦ | D.只有①②④⑤⑥⑧ |
有下列物质:①乙醇;②苯酚;③乙醛;④丙烯酸(CH2=CHCOOH);⑤乙酸乙酯, 其中与溴水、KMnO4酸性溶液、NaHCO3溶液 、Na都能反应的是( )
| A.仅①③ | B.仅②④ | C.仅④ | D.仅③④ |
某有机物甲经氧化后最终得到乙(分子式为C2H3O2Cl);而甲经水解可得丙,1mol丙和2mol乙反应得一种含氯的酯(C6H8O4Cl2);由此推断甲的结构简式为()
| A.ClCH2CH2OH | B.OHC-O-CH2Cl |
| C.ClCH2CHO | D.HOCH2CH2OH |