铁片与稀硫酸反应时,下列措施不能使氢气生成速率加快的是
| A.加几滴浓硫酸 | B.将稀H2SO4加热 | C.加CH3COONa(s) | D.改用铁粉 |
下列溶液一定是碱性的是()
| A.滴加甲基橙后溶液显红色 | B.滴加甲基橙后溶液显黄色 |
| C.溶液中含有OH-离子 | D.溶液中c (OH-)>c(H+) |
水的电离过程为H2O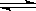 H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是()
H++OH-,在不同温度下其平衡常数为K(25℃)=1.0×10-14,K(35℃)=2.1×10-14。则下列叙述不正确的是()
| A.c(H+)随着温度升高而升高 | B.35℃时,c(H+)>c(OH-) |
C.水的电离度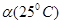 < <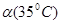 |
D.水的电离是吸热的 |
下列有关“电离平衡”的叙述中正确的是()
| A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等 |
| B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡 |
| C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动 |
| D.电解质达到电离平衡后,各种离子的浓度相等 |
下列事实不能用勒夏特列原理解释的是()
| A.新制的氯水在光照条件下颜色变浅 |
| B.开启啤酒瓶后,瓶中立刻泛起大量泡沫 |
| C.高锰酸钾(KMnO4)溶液加水稀释后颜色变浅 |
| D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率 |
在同体积同浓度的H2SO4、HCl、HNO3、CH3COOH溶液中,分别加入足量的Zn,下列说法中正确的是()
| A.硫酸中放出氢气量最多 | B.醋酸中放出氢气量最多 |
| C.盐酸中放出的氢气量最多 | D.盐酸和硝酸中放出的氢气相等 |