某反应能量变化如右下图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列叙述正确的是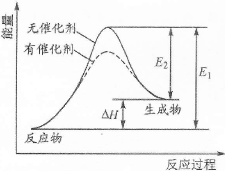
| A.该反应为放热反应 |
| B.催化剂能改变反应的焓变 |
| C.催化剂能降低反应的活化能 |
| D.逆反应的活化能大于正反应的活化能 |
原子X转移一个电子给原子Y,形成化合物HY,下列说法正确的是()
| A.X被氧化了 | B.X是氧化剂 |
| C.X发生还原反应 | D.Y在反应中表现了氧化性 |
在室温条件下,保存下列药品的方法不正确的是()
| A.氢氧化钠用带玻璃塞的玻璃瓶保存 | B.保存液溴要加少量水形成液封 |
| C.硝酸银溶液装在棕色瓶中避光保存 | D.钠保存在煤油中 |
长期以来一直认为氟的含氧酸不存在,自1971年美国科学家用F2通过细冰来获得次氟酸(HFO)以来,对HFO的研究引起了充分重视。
(1)次氟酸能与水反应得到溶液A,A中含B、C两种溶质,B常用于雕刻玻璃,C在加热条件下分解生成一种能使带火星的木条复燃的气体(已知2H2O2 2H2O+O2↑),则次氟酸与水反应的化学方程式为。
2H2O+O2↑),则次氟酸与水反应的化学方程式为。
(2)写出在加热条件下F2(g)跟烧碱反应的化学方程式:。
(3)判断次氟酸中氧元素的化合价。
已知氯化碘(ICl)的性质类似于卤素,有很强的化学活性。ICl跟Zn、H2O分别发生如下反应:2ICl+2Zn ZnCl2+ZnI2,ICl+H2O
ZnCl2+ZnI2,ICl+H2O HCl+HIO,下列叙述正确的是()
HCl+HIO,下列叙述正确的是()
| A.在Zn跟ICl的反应中,ZnI2既是氧化产物,又是还原产物 |
| B.在Zn跟ICl的反应中,ZnCl2既不是氧化产物,又不是还原产物 |
| C.在H2O跟ICl的反应中,ICl既是氧化剂,又是还原剂 |
| D.在H2O跟ICl的反应中,ICl既不是氧化剂,又不是还原剂 |
下列关于卤素的描述正确的是()
A.若X表示卤素,则卤素单质与水反应的通式为:X2+H2O HXO+HX HXO+HX |
| B.卤化氢都极易溶于水,其溶液都是强酸 |
| C.卤化氢都可以用卤化物和浓H2SO4反应制取 |
| D.卤素化合物中卤素的最高正价不都是+7价 |