工业上可利用合成气(CO和H2的混合气体)生产甲醇。已知:
CO(g)+2H2(g) CH3OH(g) ΔH=—92.9kJ/mo1
CH3OH(g) ΔH=—92.9kJ/mo1
一定条件下,该反应在一体积固定的密闭容器中达到平衡。下列说法正确的是
| A.该反应的△S<0 |
| B.该反应在任何温度下均能自发进行 |
| C.向容器中充入少量He,平衡向正反应方向移动 |
| D.升高温度平衡向正反应方向移动 |
某固体物质和某溶液在一定条件下反应,产生气体(恢复至常温)的平均相对分子质量为45.8,则发生反应的物质不可能是
| A.Zn和浓H2SO4 | B.C和浓HNO3 |
| C.Cu和浓HNO3 | D.Na2O2和NH4Cl浓溶液 |
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
| B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色 |
| C.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3- |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
某同学设计了以下几个实验,其中正确的为
A.实验室从海带提取单质碘的方法是:取样 灼烧 灼烧 溶解 溶解 过滤 过滤 萃取 萃取 |
| B.在配制一定物质的量浓度的溶液时,先称量或量取物质,再溶解或稀释,并将溶液转移至容量瓶,洗涤烧杯和玻璃棒并将洗涤液转移到容量瓶,继续往容量瓶中加水至溶液的凹液面正好与刻度线相切 |
| C.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须润洗后方可使用 |
| D.欲检验SO2中是否混有CO2,可将该气体依次通过盛有饱和碳酸氢钠溶液、品红溶液、澄清石灰水的洗气瓶,若品红溶液不褪色且澄清石灰水变浑浊,则证明混有CO2 |
汞(熔点-39℃,沸点356℃)是制造电池、电极等的重要原料,历史上曾用“灼烧辰砂法”制取汞。目前工业上制粗汞的一种流程图如下。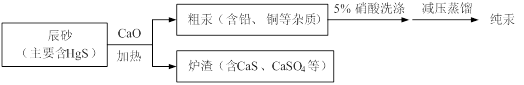
下列分析错误的是
A.“灼烧辰砂法”过程中电子转移的方向和数目可表示为: |
| B.辰砂与氧化钙加热反应时,CaSO4为氧化产物 |
| C.洗涤粗汞可用5%的盐酸代替5%的硝酸 |
| D.减压蒸馏的目的是降低汞的沸点,提高分离效率 |
锌—空气电池可能成为未来的理想动力源,该电池的电解质溶液可以是酸性或碱性。在碱性溶液中该电池总反应可表示为:2Zn+4NaOH+O2=2Na2ZnO2 +2H2O。下列有关锌-空气电池说法正确的是
| A.碱性电解质溶液中正极反应式为:4OH-- 4e-= O2↑+2H2O |
| B.碱性或酸性电解质溶液中,该电池正极反应式相同 |
| C.该电池工作时,Na+移向负极 |
| D.每生成1 mol ZnO22-转移电子数为2NA |