迄今为止,由化学能转变的热能或电能仍然是人类使用的主要的能源。
I.请仔细观察下列两种电池的构造示意图,完成下列问题: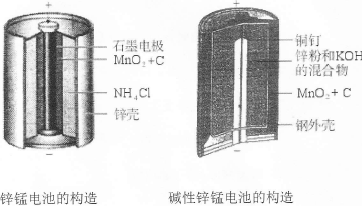
(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是 。
(2)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式为 。
Ⅱ.下面是一个将化学能与电能相互转化的装置。回答下列问题: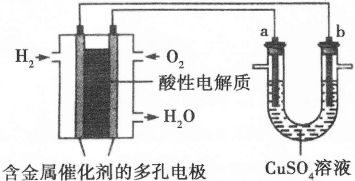
(1)写出通入O2一极的电极反应方程式为 。
(2)a电极是 极,能否写出其电极反应方程式 (填“能”或“不能”),若“能”写出其电极反应方程式,若“不能”说明其理由 。
(3)下列说法不正确的是( )
| A.此装置用于电镀铜时,电解一段时间,硫酸铜溶液的浓度不变 |
| B.U型管中,OH—在a极放电 |
| C.若a为纯净金属,b为粗制金属,该装置可用于粗制金属的精炼 |
| D.电子经导线流入b电极 |
Ⅲ.某同学运用所学知识,自选材料设计实验,实现了在通常条件下不能发生的反应:Cu+H2SO4(稀)=CuSO4+H2↑。请在下面框中画出能够实验这一反应的装置图,并在图中进行必要的标注。
在250℃时,吲哚与乙醇酸在碱的存在下反应,可以得到植物生长素吲哚乙酸:
由邻硝基甲苯1和草酸二乙酯2反应最终可合成吲哚5(Et表示CH3CH2—):
乙醇酸的合成: 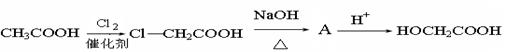
(1)物质4的分子式是,吲哚乙酸的含氧官能团的名称是;
(2)邻硝基甲苯与草酸二乙酯反应除生成物质3外,还有另外一种有机物是,
该反应的反应类型是;
(3)生成物质A的化学方程式是;
(4)已知乳酸的结构简式为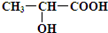 ,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):;
,请写出乳酸与吲哚发生反应的化学方程式(不用写反应条件):;
(5)邻硝基甲苯苯环上含有氨基的同分异构体有多种,请写出其中一种的结构简式。
由冰铜(mCu2O·nFeS)冶炼得到粗铜,再以粗铜为原料制纯铜的流程如下: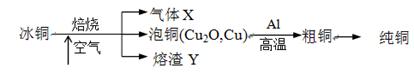
请回答下列问题:
(1)气体X是。
(2)某研究性学习小组用熔渣Y与CO反应来制取Fe。
①请按气流由左到右的方向连接下列各装置,顺序为A→________。
②装置C的作用是________________。
③在点燃D处的酒精灯前,应进行的操作是__________________。

(3)熔渣Y中铁元素的价态有+2价和+3价,根据限选试剂,设计实验方案验证熔渣Y中有+2价铁元素存在,写出有关实验操作、预期现象与结论。
限选试剂: 3 mol·L-1H2SO4、6 mol·L-1HNO3、3% H2O2、0.01 mol·L-1KMnO4、20% KSCN。
。
(4)写出泡铜冶炼粗铜反应的化学方程式。
(5)根据限选材料画出用粗铜提炼纯铜的装置图,并进行必要的标注。
限选材料:FeSO4(aq)、CuSO4(aq)、粗铁、纯铁、粗铜、纯铜、烧杯、直流电源、导线。
从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化剂是。
(2)步骤②中,为提高浸出率,可采取的措施有。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)从水浸后的滤液中得到K2SO4晶体的方法是。
(4)步骤③电解的化学方程式是,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为吨(列出计算表达式)。
磷在自然界常以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物有着广泛的应用。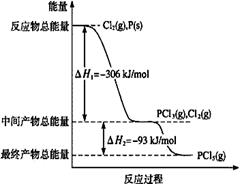
(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
请回答问题:
①PCl5分解成PCl3和Cl2的热化学方程式是。
②P和Cl2分两步反应生成1 mol PCl5的△H3=。
(2)PCl5分解成PCl3和Cl2的反应是可逆反应。T℃时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,经过250 s达到平衡。反应过程中测定的部分数据见下表:
| t / s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3) / mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
①反应在50~150s 内的平均速率v(PCl3)=。
②试计算该温度下反应的平衡常数(写出计算过程,保留2位有效数字)
(3)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH 的关系如图所示。
①为获得较纯的Na2HPO4,pH应控制在;pH=6时,溶液中主要含磷物种浓度大小关系为:。
②Na2HPO4溶液呈碱性,加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从离子平衡角度分析)。
以下是一种药物Ⅳ合成部分路线: 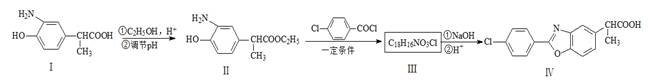 请回答下列问题:
请回答下列问题:
(1)化合物Ⅰ的分子式为,它长期暴露在空气中会变质,其原因是。
(2)化合物Ⅰ转化为Ⅱ的反应类型是。
(3)化合物Ⅰ的同分异构体A含α-氨基苯乙酸,A的苯环对位含 ,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
,则A的结构简式是 ,A在催化剂的作用下通过肽键形成高聚物,试写出该反应的化学方程式 。
(4)写出Ⅲ的结构简式。
(5) 在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。
在一定条件下发生类似化合物Ⅱ转化为Ⅲ的反应,试写出该反应的化学方程式 。