下图为某实验小组制取乙酸乙酯的实验装置图,烧瓶中盛有乙醇和浓H2SO4。反应时,将乙酸从分液漏斗滴入烧瓶中即可。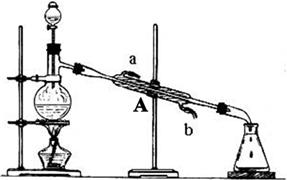
①为方便研究酯化反应的过程,乙醇中的氧原子用18O进行了标记(即C2H518OH),请用氧的同位素示踪法写出乙酸与乙醇发生酯化反应的化学方程式: 。
②装置A的名称是 ,使用时要先从 口(填“a”或“b”)进水。
③实验结束后,锥形瓶中收集到乙酸乙酯、乙醇和乙酸的混合液。为了将这三者进行分离,该小组依如下流程进行了进一步的实验: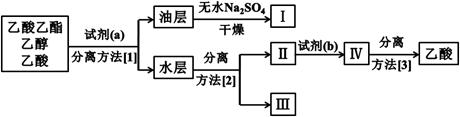
试剂(a)是 ,试剂(b)是 ,
分离方法(1)是 ,分离方法(2)是 ,分离方法(3)是 。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
(1)写出该反应的热化学方程式。
(2)关于该反应的下列说法中,正确的是。
A.△H>0,△S>0B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:。
(4)温度降低,平衡常数K(填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=。
(6)下列措施中能使 增大的有。
增大的有。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
已知反应:3Cl2+8NH3==N2+6NH4Cl
(1)若有71gCl2参加反应,被氧化的物质是;转移电子的物质的量为mol。
(2)反应后,若产生14g N2,则有g NH3被氧化。
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要98%密度为1.84g/cm3的浓硫酸mL
(2)配制时,必须使用的仪器有 (填代号) 还缺少的仪器是 。
①烧杯 ②100 mL量筒 ③20 mL量筒④1000 mL容量瓶⑤250 mL容量瓶 ⑥托盘天平(带砝码)⑦玻璃棒
(3)配制时,该实验两次用到玻璃棒,其作用分别是、。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,取出水使液面恰好到刻度线。 。
③容量瓶没有干燥。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液 | B.升华 | C.结晶 | D.分液 E.蒸馏 F.层析 G.过滤 |
(1)______分离饱和食盐水与沙子的混合物。
(2)___从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)___分离水和汽油的混合物。
(4)___分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
用双桥法分析下列反应,并指出氧化剂和还原剂。
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)2H2+ O2 ==2H2O