设阿伏加德罗常数为NA, 下列叙述中正确的是
| A.常温常压下, 32克氧气中原子个数为NA |
| B.标准状况下, 1mol H2O的体积为22.4L |
| C.常温常压下, 1molH2的质量为2克 |
| D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是
| A.NH4Cl | B.NH4HCO3 | C.CH3COONH4 | D.NH4HSO4 |
25℃时,水的电离达到平衡:H2O H++OH-;△H>0,下列叙述正确的是
H++OH-;△H>0,下列叙述正确的是
| A.向水中加入少量固体NaHSO4,c(H+)增大,KW不变 |
| B.向水中加入少量NaOH溶液,平衡逆向移动,c(OH-)降低 |
| C.向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
下列事实中,能用勒沙特列原理来解释的是
| A.由H2(g)、I2(g)、HI(g)组成的混合气体平衡体系加压后颜色加深 |
| B.久置的氯水变成了稀盐酸 |
| C.在FeCl3溶液中加入铁粉防止氧化变质 |
| D.加入催化剂有利于SO2与O2反应制SO3 |
对于可逆反应2NO2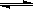 N2O4,下列状态一定是平衡状态的是
N2O4,下列状态一定是平衡状态的是
| A.N2O4和NO2的分子数之比为1∶2 |
| B.N2O4和NO2的浓度相等 |
| C.体系中各组分的浓度不再变化 |
| D.单位时间有1mol N2O4转变为NO2的同时,有1 mol NO2转变为N2O4 |
下列反应既是氧化还原反应,又是吸热反应的是
| A.铝片与稀H2SO4反应 | B.Ba(OH)2·8H2O与NH4Cl反应 |
| C.灼热的碳与CO2反应 | D.甲烷气体在O2中的燃烧反应 |