已知某亚铁盐的化学式可表示为(NH4)a Feb(S04)c。取一定质量的该亚铁盐样品全部溶于足量的水中,将所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32 g。另一份溶液同足量的浓NaOH溶液共热,产生的氨气用100 mL 0.5mo1·L-1稀硫酸吸收后(设产生的氨全部逸出),剩余的硫酸再用1.5 mol·L-1NaOH溶液中和,需NaOH溶液40mL。该亚铁盐样品中b:c的比值为
| A.1:1 | B.2:1 | C.1:2 | D.3:2 |
13.常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。下列叙述中不正确的是
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
12. 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
下列判断正确的是
| A.往平衡体系中加入少量金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应的△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
11.已知温度T时水的离子积常数为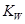 。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
。该温度下,将浓度为amol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是
| A.a=b |
| B.混合溶液的pH=7 |
C.混合溶液中,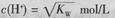 |
D.混合溶液中, |
10.在一定温度不同压强(P1<P2)下,可逆反应2A(g)  2B(g) + C(g)中,生成物C在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是
2B(g) + C(g)中,生成物C在反应混合物中的体积分数(ψ)与反应时间(t)的关系有以下图示,正确的是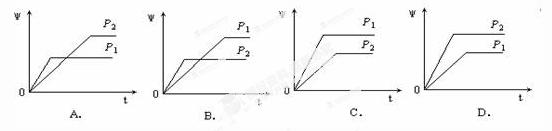
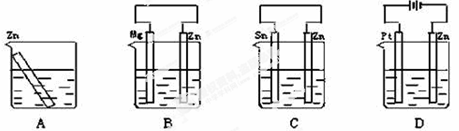
9.现有分别放置下图装置(都盛有稀H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是