在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂,F是地壳中含量最多的金属元素。(反应中生成的水和部分反应条件未列出)
(1)画出A中阴离子的结构示意图 。
(2)反应②在点燃条件下的现象是 。
(3)H转化为F的氢氧化物最好选择的试剂是 。
(4)反应③的离子方程式为 。
(5)反应④的离子方程式为 。
(1)1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,热化学方程式为
(2)已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成液态水放出571.6kJ的热量,表示氢气燃烧热的热化学方程式是
(3)Na2CO3等溶液不能存放在磨口玻璃塞的试剂瓶中,其原因是(结合离子方程式说明):;把三氯化铁溶液蒸干并充分灼烧,最后得到的固体产物是(化学式);相关反应的方程式是:、;配制FeCl2溶液时,应加入,以抑制Fe2+的水解,还应加入少量铁粉,目的是:。
A、B、C、 D、 E、F六种元素的原子序数依次增大,原子序数均小于30。其中C原子的L电子层中,成对电子与未成对电子占据的轨道数相等,且无空轨道;B原子的L电子层中未成对电子数与C相同,但还有空轨道;A,D的原子序数相差10,且A是最轻的元素;E原子最外层的p能级电子数是s能级电子数的两倍;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答问题:
(1)A的名称是________
(2)B的元素符号是________;C的电子排布图(轨道排布式)为________;B和C形成化合物电子式为:_________
(3)D的元素符号为,其原子结构示意图为。
(4)E元素的符号为,写出F原子基态的电子排布式为。
煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:C+H2O(g)——CO+H2,CO和H2的混合气体是合成多种有机物的原料气。下图是合成某些物质的路线。其中,D易溶于水,且与CH3COOH互为同分异构体,既能与银氨溶液反应,又能发生酯化反应;F分子中的碳原子数是D的3倍;H经催化氧化可得到G。请回答下列问题: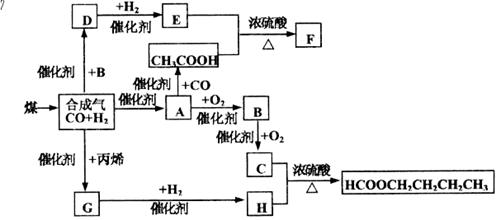
(1)写出下列物质的结构简式:E___________B__________;E与H是否属于同系物:________________(填是或否)。
(2)D的同分异构体除CH3COOH外还有:___________________;
(3)写出下列反应的化学方程式:
C+H_____________________________________________;
D与银氨溶液反应________________________________________。
(4)A为工业常用燃料。某同学将A完全燃烧,产生的二氧化碳气体通入澄清石灰水中。
若该同学实验时共取了200mL0.1mol/L的石灰水,通入一定量的二氧化碳后,得到1g沉淀,那么,他通入的二氧化碳标况下的体积可能为___________________________。
物质F是合成多种手性药物和生物活性物质的重要中间体,其合成路线如下: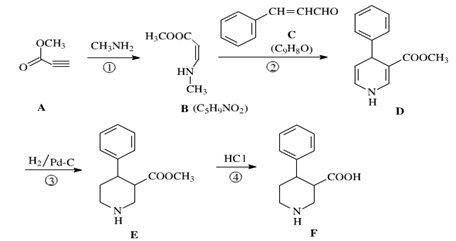
(1)反应①的类型为,反应④的类型为。
(2)物质A聚合可得聚丙炔酸甲酯,其结构简式为。
(3)物质C的俗名为肉桂醛,写出其同时满足下列条件的一种同分异构体的结构简式。
①能与氯化铁溶液显紫色;②苯环上有两个取代基;③分子的核磁共振氢谱有4个峰。
(4)若部分C被氧化为肉桂酸,反应②将产生副产物(分子式为C14H15NO3),写出其结构简式。
美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图: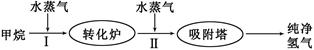
(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
830 |
| 平衡常数K |
10 |
9 |
1 |
从上表可以推断:此反应是(填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为。
(2)在500℃,以下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是
| 实验编号 |
反应物投入量 |
平衡时H2浓度 |
吸收或放出的热量 |
反应物转化率 |
| A |
1、1、0、0 |
c1 |
Q1 |
α1 |
| B |
0、0、2、2 |
c2 |
Q2 |
α2 |
| C |
2、2、0、0 |
c3 |
Q3 |
α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 ="1"
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是。
①体系的压强不再发生变化②混合气体的密度不变
③混合气体的平均相对分子质量不变④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化⑥v(CO2)正=v(H2O)逆
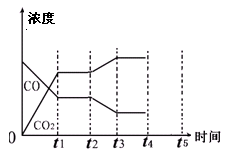
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是、
(写出两种)。若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。