下列溶液中各微粒的浓度关系正确的是
| A.0.1 mol·L-1 NaHSO4溶液中:c(Na+)>c(SO42-)>c(H+) >c(OH-) |
| B.0.1 mol·L-1Na2S溶液中:2 c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| C.0.1 mol·L-1 NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D.等体积、等物质的量浓度的乙酸溶液和氢氧化钠溶液混合后:C(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
主链含5个碳原子,有甲基、乙基2个支链的烷烃有
| A.2种 | B.3种 | C.4种 | D.5种 |
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池,①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少.据此判断这四种金属活动性由强到弱的顺序是
| A.①③②④ | B.①③④② | C.③④②① | D.③①②④ |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是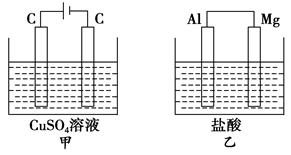
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲=V乙 |
| D.电极反应式:甲中阴极为Cu2++2e-===Cu,乙中负极为Mg-2e-===Mg2+ |
下列物质中互为同分异构体的是
| A.O2和O3 |
B.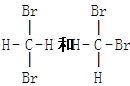 |
| C.CH3COOH和HCOOCH3 |
D.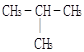 和 和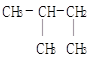 |
由锌—铜—稀H2SO4组成的原电池装置中,当导线中有0.2 mol电子通过时,理论上两极的变化是
| A.铜片增重6.4g | B.锌片增重6.5 g |
| C.铜片上析出0.1 mol O2 | D.锌片溶解了6.5 g |