在容积为1 L的密闭容器中,进行如下反应:A(g)+2B(g) 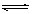 C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图。
请回答下列问题:
(1)700℃时,0~5min内,以B表示的平均反应速率为_________。
(2)能判断反应达到化学平衡状态的依据是__________。
A.容器中压强不变
B.混合气体中c(A)不变
C.v正(B)=2v逆(D)
D.c(A)=c(C)
(3)若最初加入1.0 mol A和2.2 mol B,利用图中数据计算800℃时的A的转化率 。
(4)800℃时,某时刻测得体系中物质的量浓度如下:c(A)=0.06 mol/L,c(B)=0.50 mol/L,c(C)=0.20 mol/L,c(D)=0.018 mol/L,则此时该反应 (填“向正方向进行”、“向逆方向进行”或“处于平衡状态”)。
某混合物的水溶液中,只可能含有以下离子中的若干种 :K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取10
:K+、Mg2+、Fe3+、Al3+、NH4+、Cl-、CO32-和SO42-。现每次取10 0.00mL进行实验:(已知NH4++OH-= NH3↑+H2O)
0.00mL进行实验:(已知NH4++OH-= NH3↑+H2O)
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后,整个过程没有沉淀产生,加热,收集到气体0.896L(标准状况下)
②第三份加入足量BaCl2溶液后得干燥沉淀6.27g,沉淀经足量盐酸洗涤,干燥后剩余2.33g。
请回答:
(1)c(CO32-)=______;
(2)K+是否存在?_____________;若存在,浓度至少是_________________
(若不存在,则不必回答第(2)问);
(3)根据以上实验,不能判断哪种离子是否存在?若存在,这种离子如何进行检验?
__________________________________________________________________________________________________________________________________________。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu + 8HNO3 =3Cu(NO3)2 + 2NO↑+ 4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是,氧化产物是 ;
;
(3)硝酸在反应过程中起的作用是、;
硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的;
(4)若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是
。
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①、A与B反应有气体生成; ②、B与C反应有沉淀生成;
③、C与D反应有 沉淀生成; ④、D与E反应有沉淀生成;
沉淀生成; ④、D与E反应有沉淀生成;
⑤、A与E反应有气体生成;
⑥、 ②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在反应③中,生成的沉淀物质的化学式是;
(2)B是, D是(填化学式);
(3)反应⑤的离子方程式是。
写出下列各反应的离子方程式:
(1)氧化铁与稀盐酸:;
(2)硫酸铜溶液中加入氢氧化钡溶液:;
(3)少量Ca(HCO3)2滴入足量烧碱溶液中:
。
有以下物质(填序号)
| A.Na | B.NaOH | C.FeCl3溶液 | D.胆矾 E、硫酸溶液 |
F、CaCO3 G、葡萄糖H、HCl
(1)属于电解质的是;
(2)属于化合物的有;
(3)能导电的有。