体积相同浓度均为0.1mol·L-1的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m和n的关系正确的是
| A.m>n | B.m=n | C.m<n | D.不能确定 |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减少 |
| B.溶液中c(CH3COO-)/[c(CH3COOH)··c(OH-)]不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH=7 |
实验测得:101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ的热量;1 mol CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=+890.3 kJ·mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
④2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
| A.仅有② | B.仅有②④ | C.仅有②③④ | D.全部符合要求 |
下列有关说法正确的是
| A.放热反应在任何条件都能自发进行 |
| B.应用盖斯定律,可计算某些难以直接测量的反应焓变 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.电解精炼铜时,外电路中转移电子数为2NA个时,阳极铜质量减少64g |
已知:HCN(aq)与NaOH(aq)反应的△H=" -12.1kJ" /mol;HCl(aq)与NaOH(aq)反应的△H =" -55.6kJ/" mol。则HCN在水溶液中电离的ΔH等于
| A.-67.7 kJ /mol | B.-43.5kJ /mol |
| C.+43.5 kJ/ mol | D.+67.7 kJ/ mol |
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N−N为154,则断裂1molN−H键所需的能量(kJ)是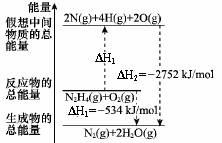
| A.194 | B.391 | C.516 | D.658 |