下列离子或分子在pH=0的溶液中能大量共存的是
| A.Na+、Cu2+、SO42—、NH3·H2O |
| B.K+、Al3+、MnO4—、C2H5OH |
| C.K+、Cl—、NO3—、Fe2+ |
| D.Na+、NH4+、CH3COOH |
下列离子方程式错误的是
| A.向FeBr2溶液中通入少量的Cl2,2Fe2+ + Cl2 = 2Fe3+ + 2Cl- |
| B.向FeBr2溶液中通入等物质的量的Cl2,2Fe2+ + 2Br-+ 2Cl2 = 2Fe3+ + Br2 + 4Cl- |
| C.向FeBr2溶液中通入足量的Cl2,2Fe2+ + 4Br-+ 3Cl2 = 2Fe3+ + 2Br2 + 6Cl- |
D.向苯酚钠溶液中通入“少量”的CO2, |
下列事实、离子方程式及其对应关系均正确的是
| A.铁溶于稀硝酸,溶液变为浅绿色:Fe + 4H+ + NO3— = Fe3+ + NO ↑ + 2H2O |
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色: Cr2O72-(橙色) + H2O 2CrO42-(黄色) +2H+ 2CrO42-(黄色) +2H+ |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H+ + 4I- + O2 =2I2 + 2H2O |
D.向水杨酸( )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: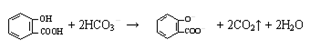 |
下列情况下,离子组间一定能在溶液中同时大量共存的是
| A.pH=2的溶液中:SO42-、K+、NO3-、Mg2+ |
| B.pH试纸呈现红色的溶液:Fe2+、K+、NO3-、Na+ |
| C.水电离出的c(H+)=10-14mol/L的溶液中:Na+、HCO3-、Cl-、SO42- |
| D.CO32-可以大量存在的溶液:Ag+、K+、NO3-、Al3+ |
下列表示对应化学反应的离子方程式正确的是
| A.用氯化铁溶液腐蚀铜板:Cu+Fe3+=Cu2++Fe2+ |
| B.碘水中通入适量的SO2:I2+SO2+2H2O=2I-+SO42-+4H+ |
| C.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+ |
| D.往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
下列各组离子在指定条件下,一定能大量共存的是
| A.能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3- |
| B.c(H+)=1×10-1 mol/L的溶液中:Cu2+、Al3+、SO42-、NO3- |
| C.能使碘化钾淀粉试纸变蓝的溶液中:Na+、NH4+、S2-、Br- |
| D.水电离出的c(H+)=1×10-12 mol/L的溶液中:Na+、Mg2+、Cl-、SO42- |