铁、铝、铜及其化合物在生产、生活中有广泛的用途,试回答下列问题:
(1)铝的原子结构示意图为___________;铁、铝、铜三种金属的金属活动性由弱到强的排列顺序是__________。
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,请写出该反应的离子方程式:_________________。
(3)如图装置中,铁作________极,铜电极的电极反应式为_________________________。
(4)已知铜与稀硫酸不反应,但铜片在稀硫酸中长时间加热时溶液会呈蓝色,请用化学方程式表示其原因:__________________________________________________________。
(5)氯化铝广泛用作有机合成和石油工业的催化剂。将铝土矿粉(主要成分为A12O3)与焦炭混合后加热并通人氯气,可得到氯化铝,同时生成CO,写出该反应的化学方程式:_____________________________ ,该反应的氧化剂是_________________。
(6)某校兴趣小组为测定一种铁铝硅合金 (FexAlySiz) 粉末的组成,提出如下方案:准确称取1.46 g该合金粉末,加入过量盐酸溶液,充分反应后过滤,测定剩余固体质量0.07 g。向滤液中滴加足量NaOH浓溶液,充分搅拌、过滤、洗涤得固体。再将所得固体充分加热、灼烧,得红棕色粉末1.60g,通过计算确定此合金的组成为________________ (填化学式)。
A、B、C、D、E是位于短周期的主族元素,其中A、B为金属元素,D的最外层电子数是其内层电子数的三倍。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:
具有相同的电子层结构;③B与E在同一周期,在该周期中,E的原子半径最小,B的离子半径最小;④A、B所形成的单核离子具有相同的电子层结构,B的最高价氧化物对应的水化物与A、E的最高价氧化物对应的水化物都能反应。依据上述信息回答下列问题:
(1)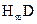 的电子式:_____________。
的电子式:_____________。
(2) 、
、 的还原性强弱为_________>___________,能证明其还原性强弱的离子方程式为____________________________。
的还原性强弱为_________>___________,能证明其还原性强弱的离子方程式为____________________________。
(3)写出B的最高价氧化物对应的水化物和A的最高价氧化物对应的水化物反应的离子方程式______________________________。
(4)A和E形成的化合物,其晶体类型属___________;该晶体中离A最近的A有_____个。A和E形成化合物的熔点比C和E形成化合物的熔点_________(填高或低)。
(5)常温下,将等物质的量浓度的 溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为_______________。
溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性,溶液中离子浓度由大到小的顺序为_______________。
下列四种溶液中,①pH=0的盐酸②0.1 mol·L-1的盐酸③0.01 mol·L-1的NaOH溶液④pH=11的NaOH溶液。由水电离生成的氢离子浓度之比是__________________。
在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如下图,据图回答下列问题: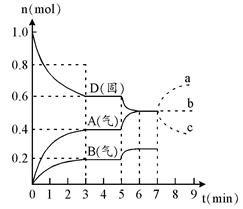
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为。
(2)根据右图写出该反应的化学方程式。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如右图,则该反应是(填“放热”或“吸热”)反应。若在第7分钟时增加D的物质的量,A的物质的量变化正确的是_____(用图中a~c的编号回答)
(4)某同学在学习了“化学反应速率和化学平衡”专题后,发表如下观点,你认为错误的是。
a.化学反应速率理论是研究怎样在一定时间内快出产品
b.化学反应速率理论是研究怎样提高原料转化率
c.化学平衡理论是研究怎样使用有限原料多出产品
d.正确利用化学反应速率和化学平衡理论都可以提高化工生产的综合效益
可逆反应A(气)+B(气) 3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:
3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系: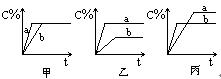
(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则___曲线是表示有催化剂时的情况。
(2)若乙图中的a曲线表示200℃和b曲线表示100℃时的情况,则此可逆反应的正反应是_____热反应。
(3)若丙图中两条曲线分别表示不同压强下的情况,则____曲线是表示压强较大的情况。
(1)在密闭容器中有H2O(g) +C(s)  CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将。(填“增大”、“减小”或“不变”下同)
CO(g) + H2(g)反应,一定条件下达到平衡,①增大水蒸汽浓度,平衡向反应方向移动(填“正”、“逆”或“不”下同),CO的浓度将。(填“增大”、“减小”或“不变”下同)
②增加H2浓度平衡向反应方向移动,CO的浓度将。
(2)用注射器吸入少量NO2和N2O4的混合气体,发生如下反应:
2NO2(g) N2O4(g)当活塞迅速向外拉时,平衡向反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。
N2O4(g)当活塞迅速向外拉时,平衡向反应方向移动,气体的颜色先变_____(“浅”、“深”或“不变”下同),后变______;最终和最初相比,_____更深(填“前”或“后”)。