已知:H2(g)+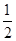 O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
O2(g)=H2O(l) ΔH1=-285.8 kJ·mol-1 ①
H2(g)=H2(l) ΔH2=-0.92 kJ·mol-1 ② O2(g)=O2(l) ΔH3=-6.84 kJ·mol-1 ③
H2O(g)=H2O(l) ΔH4=-44 kJ·mol-1 ④
下列说法正确的是
| A.上述四个反应都是吸热反应 |
| B.1 mol液态H2的能量大于1 mol气态H2的能量 |
| C.H2的燃烧热(ΔH)为-285.8 kJ·mol-1 |
D.火箭中液氢燃烧的热化学方程式为H2(l)+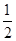 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 O2(l)=H2O(g) ΔH=-285.8 kJ·mol-1 |
某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl-、SO42-、CO32-、AlO2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: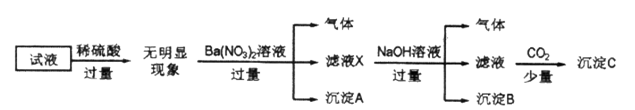
下列说法正确的是
| A.无法确定原试液中是否含有Al3+、Cl- |
| B.滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ |
| C.原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- |
| D.无法确定沉淀C的成分 |
下列叙述正确有几个
①晶体中不一定存在分子间作用力,但一定存在化学键
②液态氟化氢中存在氢键,所以其分子比氯化氢更稳定
③向Fe(NO3)2溶液中通入过量的HI,最终Fe2+被氧化生成Fe3+
④将SO2通入紫色石蕊溶液,溶液先变红,后褪色
⑤将过量的二氧化碳气体通入硅酸钠溶液中,然后加热蒸干,再在高温下充分灼烧,最后得到的固体为碳酸钠和二氧化硅
| A.0个 | B.1个 | C.2个 | D.3个 |
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
| A.①②③④ | B.①③④⑤ | C.②④⑤ | D.①②③④⑤ |
下列对于实验I~IV的说法正确的是
| A.实验I: 逐滴滴加盐酸时,试管中立即产生大量气泡 |
| B.实验II:可比较氯、碳、硅三种元素的非金属性强弱 |
| C.实验III:从饱和食盐水中提取NaCl晶体 |
| D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色会逐渐变浅乃至褪去 |
下列有关反应的离子方程式书写正确的是
| A.将Na加入CuSO4溶液中:Na+Cu2+=Cu+2Na+ |
| B.将NaHSO4溶液加入Ba(OH)2溶液中至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C.向氯化铝溶液中加入足量氨水:Al3++4NH3∙H2O=AlO2-+2H2O+4NH4+ |
| D.向Ca(OH)2溶液中通入过量SO2:SO2+ OH-=HSO3- |