高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
|

| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-―→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
书写离子方程式(8分)
(1) 铜和足量浓硝酸反应的离子方程式为
(2)二氧化锰与足量浓盐酸反应的离子方程式为:
(3)向碳酸氢钾溶液中滴入少量澄清石灰水反应的离子方程式为:
(4)向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为
【化学——选修5:有机化学基础】
3对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: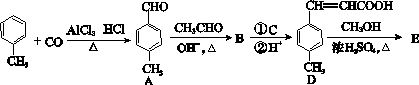
已知:HCHO+CH3CHO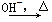 CH2===CHCHO+H2O
CH2===CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有____________种,写出其中一种的结构简式,某有机物比A多一个氧原子,它有多种同分异构体,其中属于芳香酯的有种,B中含氧官能团的名称为________。
(2)试剂C可选用下列中的________。
a.溴水 b.银氨溶液
c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(3) 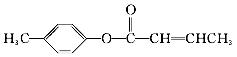 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________。
(4)E在一定条件下可以生成高聚物F,F的结构简式为__________________________。
【化学——选修3:物质结构与性质】
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;X基态原子的电子排布图是
Z所在周期中第一电离能最大的主族元素是________(写出元素名称)。R原子结构示意图为。
(2)XY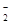 的立体构型是________;R2+的水合离子中,
的立体构型是________;R2+的水合离子中,
提供孤电子对的原子是________(写出元素符号)。
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。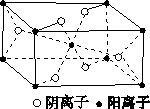
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是____________________________________。
【化学——选修2:化学与技术】
木糖醇(C5H12O5)可用作甜味剂、营养剂,在化工、食品、医药等工业中有广泛应用。利用玉米芯中的多糖可以生产木糖醇,其工艺流程如下:
1—浸泡罐;2、3—反应罐;4—板式过滤机;5、10—浓缩罐;
6—脱色柱;12—离心机(固液分离装置)
已知:木糖与木糖醇的转化关系如图: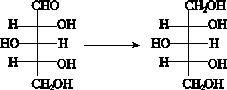
请回答下列问题:
(1)装置2中硫酸的主要作用是________。
(2)装置3中加入碳酸钙的目的是_____________________________________。
(3)为除去木糖浆中的杂质离子,7、8装置中的填充物依次是_____________________。
(4)装置9的作用是________。
| A.冷却木糖浆 | B.水解木糖 | C.氧化木糖 | D.还原木糖 |
(5)装置11的作用是________。