亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内反应的离子方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发浓缩 c.灼烧 d.过滤洗涤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
在呼吸面具和潜水艇中可以用过氧化钠作为供氧剂。某化学探究学习小组选用适当的化学试剂和实验用品,用下图中实验装置,进行实验来证明过氧化钠可作供氧剂。其中,A是实验室制取CO2的装置,D中装有过氧化钠固体。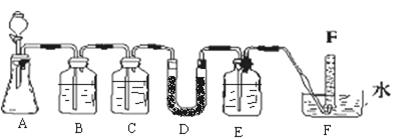
(1)写出A装置中发生反应的离子方程式:;
(2)填写表中空格:
| 仪器 |
加入试剂 |
加入该试剂的目的 |
| B |
饱和NaHCO3溶液 |
|
| C |
除去CO2中的水蒸气 |
|
| E |
(3)若无C装置,对实现该实验目的是否有影响(填“是”或“否”),
原因;
(4)试管F中收集满气体并从水中取出后,下一步实验操作为:。
为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
| A.冷却至室温后,在250mL容量瓶中定容配成250mL稀硫酸。 |
| B.用某仪器量取25.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。 |
| C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。 |
| D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1mL。 |
E.小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2mL。
F.把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G.用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
请完成下列填空:
⑴正确操作步骤的顺序(用编号字母填写)。
⑵用来量取10.00mL浓硫酸的仪器是,用NaOH溶液润洗碱式滴定管的目的是。
⑶滴定中可选用的指示剂是,滴定中,目光应注视___ __ 。
⑷某学生实验时用稀硫酸润洗了锥形瓶测定的浓度会偏_。(填“偏高”、“偏低”或“无影响”)
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成,为了检验它们,做了以下实验。
(1)将固体溶于水,搅拌后得到无色透明溶液;
(2) 往此溶液中滴加硝酸钡溶液,有白色沉淀生成;
(3) 过滤,将沉淀置于稀硝酸中,发现沉淀全部溶解,试判断:
①.固体混合物中肯定有;肯定没有;可能有;对可能有的物质,可采用往滤液中滴加试剂的方法来检验。
②.操作(2)中反应的离子方程式。
③.操作(3)中反应的化学方程式。
现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
回答下列问题:
(1)装置A中液体试剂选用____________,理由是__________________________。
(2)装置B的作用是___________________,装置E中碱石灰的作用是___________。
(3)装置D中发生反应的化学方程式是:____________________、_______________________。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为______。
某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。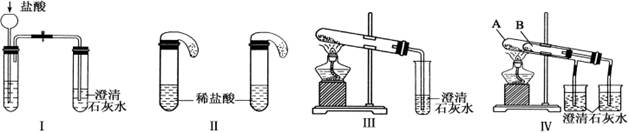
(1)只根据图Ⅰ、Ⅱ所示实验,能够达到实验目的的是(填装置序号)________;
(2)图Ⅲ、Ⅳ所示实验均能鉴别这两种物质,其都能发生的反应的化学方程式为_____________
_______________;与实验Ⅲ相比,实验Ⅳ的优点是_________________________;
(3)有同学认为,除上述试验方法外,向两种固体配成的溶液中加入澄清石灰水也可以区分它们,这种说法是_____________(填“正确”或“错误”)的。
(4)另有两瓶溶液,已知分别是K2CO3和NaHCO3,请你写出两种不同的鉴别方法。
①______________________________________;②________________________________。