25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是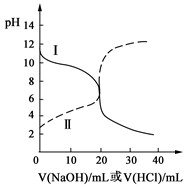
| A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+) |
| D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)] |
CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是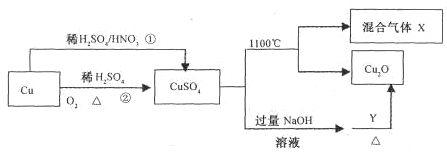
| A.相对于途径①,途径②更好地体现了绿色化学思想 |
| B.Y可以是葡萄糖溶液 |
| C.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1 mol |
| D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2 |
一定温度下,将1 mol A和1 mol B气体充入2L恒容密闭容器,发生反应A(g)+B(g)  xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确是
| A.反应方程式中的x=l |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质D |
| D.t1~t3间该反应的平衡常数均为4 |
下图所示装置I是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学方程式为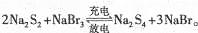 闭合开关K时,b极附近先变红色。下列说法正确的是
闭合开关K时,b极附近先变红色。下列说法正确的是
| A.当有0.01 mol Na+通过离子交换膜时,b电极上析出112 mL的气体 |
| B.负极反应为3Br--2e-= Br3- |
| C.闭合K后,b电极附近的pH变小 |
| D.闭合K后.a电极上有氯气产生 |
用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是
| 选项 |
甲 |
乙 |
丙 |
试管中现象 |
| A |
浓盐酸 |
二氧化锰 |
石蕊溶液 |
先变红后褪色 |
| B |
浓氨水 |
生石灰 |
A1Cl3溶液 |
先沉淀后消失 |
| C |
醋酸 |
碳酸钙 |
BaC12溶液 |
变浑浊 |
| D |
浓硝酸 |
铜 |
水 |
试管口出现红棕色 |
下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是
| A.氯气:K+、Ba2+、SiO32-、NO3- |
| B.二氧化硫:Na+、NH4+、SO32-、C1- |
| C.氨气:K+、Na+、AlO2-、CO32- |
| D.甲醛:Ca2+、Mg2+、MnO4-、NO3- |