A、B、C、D、E、F是元素周期表中前20号元素,它们的原子序数依次增大。A、B可分别与C组成常见化合物AC、AC2、BC、BC2;D元素的焰色反应呈黄色;E、F两元素单质的沸点与元素原子序数的关系如图(图中原子序数连续)。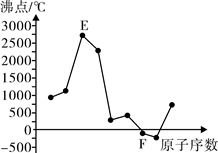
(1)A在元素周期表中的位置是 。
(2)B2的电子式为 ,C、D、F对应的简单离子半径由小到大的顺序为 (用离子符号表示)。
(3)C、F的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
(4)化合物Y由C、E两元素组成,将Y、B单质与A单质按1∶1∶3在一定条件下反应可得到Z和AC,Z的化学式为 。
Ⅰ.短周期元素R被称为“生命元素”,R元素的最价高氧化物对应的水化物能与其气态氢化物化合生成盐A,写出生成A的化学方程式。
Ⅱ.将一定量Mg、Al合金溶于40 mL的H2SO4溶液中,然后向所得溶液中滴加1 mol·L-1 的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。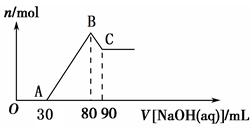
(1)合金中Mg、Al的物质的量之比为 ________。
(2)所加硫酸的物质的量浓度为__________。
A、B、C、D、E属于短周期元素,且原子序数依次增大,已知A 与E同主族,B、C、D、E同周期,A与B可形成两种离子化合物甲和乙,在甲中A、B 离子的电子层结构相同;C的简单离子半径是同周期所有离子中最小的,高纯度的D单质可制造芯片;又知 C、D的单质都能与强碱溶液反应。
(1)写出: AD(元素符号),乙(化学式)
(2)E元素在周期表中的位置是第周期,第族。
(3)画出B的原子结构示意图;
(4)C单质与NaOH溶液反应的离子方程式;
(5)举出C单质在工业上的一种重要用途(必须用化学方程式表示)。
下表是元素周期表的一部分,请回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
|||
| 四 |
⑧ |
⑨ |
(1)在这些元素中,最活泼的非金属元素是 (元素符号),原子最外层达到稳定结构的元素是(元素符号);
(2)元素的最高价氧化物对应的水化物中酸性最强的是(填化学式);
(3)写出③、④的最高价氧化物对应的水化物相互反应的化学方程式
;
(4)③、⑥、⑧的原子半径由大到小为﹥﹥(填元素符号),
①、⑤的最高价含氧酸酸性﹥(均填化学式);
(5)写出证明非金属性⑥比⑨强(用置换反应证明)的化学方程式;
(6)写出工业上制备⑤单质的化学方程式。
写出下列反应的热化学方程式:
(1)10g乙烷(C2H6)气体完全燃烧生成液态水放出热量520kJ.
(2)10gCaCO3高温分解吸收热量17.56kJ.
某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
(1)图中所给数据进行分析,该反应的化学方程式为。
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为v(Z)=。
(3)当反应进行到第min,该反应达到平衡。