A、B、C、D均为中学化学中的常见物质,请根据题中信息回答问题。
(1)已知它们存在如下反应转化关系:A +B→C +D(未配平,反应条件略去)。
①该转化关系中所涉及的反应为置换反应。若A是金属单质,D是非金属单质,且A 原子的质子数是D原子的2倍,则反应的方程式是 。
②该转化关系中所涉及的反应为非置换反应。若A、D分子的核外电子总数都为10个,B与C能发生反应,则反应的方程式是 。
(2)已知它们存在如下反应转化关系:A +B→C +D+H2O(未配平,反应条件略去)。
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,当A的摩尔质量小于B时,物质B的名称为 ,鉴别C、D两种气体不能选用的试剂是 。
a.Ba(OH)2溶液
b.酸性KMnO4溶液
c.紫色石蕊试液
d.H2O2与BaCl2混合液
e.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C。当参加反应的A、B物质的量之比为3∶4时,则C与D物质的量之比为 。
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于
晶体;Ni元素在元素周期表中的位置是第周期,第族;镍有 Ni和 Ni两种原子,它们互称为。
(2)如图所示配合物分子内的作用力有(填编号)。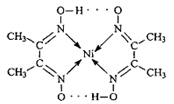
| A.氢键 |
| B.离子键 |
| C.共价键 |
| D.金属键 |
E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。
如①CH2=CH2、②CH≡CH、③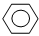 、④HCHO等,其中分子属于平面结构的有(填物质序号),预测HCHO分子的立体结构为形。
、④HCHO等,其中分子属于平面结构的有(填物质序号),预测HCHO分子的立体结构为形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上。该晶体的化学式为。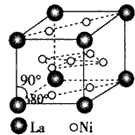
已知X、Y、Z、Q、E五种元素的原子序数依次增大,其中X原子核外电子有6种不同的运动状态,s能级电子数是p能级电子数的两倍;Z原子L层上有2对成对电子;Q是第三周期中电负性最大的元素;E的单质是常温下唯一呈液态的非金属。请回答下列问题:
(1)X、Y、Z第一电离能由小到大的顺序为(填元素符号)。Y的氢化物的分子空间构型是。其中心原子采取杂化,属__________(填“极性”或“非极性”)分子。
(2)E元素基态原子的电子排布式为。
(3)XZ2分子中含有个π键。
(4)Z氢化物的沸点比Q氢化物的沸点高,理由是。
(5)X元素可形成X60单质,它与金属钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示(白球位于立方体的体心和顶点,小黑球位于立方体的面上),该化合物中X60与钾原子个数比为。
下表为元素周期表的一部分,a、b、c……为部分元素。回答下列问题:
| a |
|||||||||||||||||
| f |
h |
i |
|||||||||||||||
| b |
e |
j |
|||||||||||||||
| c |
d |
g |
k |
||||||||||||||
| l |
(1)请写出上述元素d3+的核外电子排布式;
(2)请写出j的单质与a、h形成的化合物发生反应的化学方程式;
(3)请比较b、e、j三种元素的电负性由大到小的顺序(写元素符号);此三种元素的第一电离能由大到小的顺序(写元素符号);
(4)g、e两种元素的最高价氧化物对应的水合物的化学性质相似,请写出e元素最高价氧化物对应的水合物与a、c、h三种元素形成的化合物反应的离子方程式;
(5)j、k、l三种元素之间能以原子个数比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出k、l的互化物的电子式,它是由键(根据原子轨道的重叠程度填写)形成的化合物(填“离子”或“共价”)。
有如下几种物质:
| A.金刚石、 |
| B.MgF2、 |
| C.NH4Cl、 |
| D.NaNO3、 |
E.干冰、
F.固体碘。
选取适当物质填写下列空白。
(1)熔化时不需破坏化学键的是_______,熔化时只需破坏共价键的是_____,熔点最高的是________,熔点最低的是________。
(2)晶体中既存在离子键又存在共价键的是_______,只存在离子键的是_____。
(3)由极性键构成的非极性分子有________。
(4)可溶于CCl4的有________。
(18分)
Ⅰ.(7分)次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性。试回答下列问题:
(1)P的原子结构示意图为;
(2)NaH2PO2为(填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为。
(3)H3PO2可将溶液中的银离子还原为银单质,若氧化剂与还原剂的物质的量之比为4︰1,则该反应的氧化产物的化学式为。
Ⅱ.(11分)某无机化合物A的相对分子质量为184。在一定条件下,SCl2与氨完全反应生成A和淡黄色单质B及离子化合物X,且X的水溶液的pH<7。将18.4gA隔绝空气加强热可得到12.8g B和气体单质C。请回答下列问题:
(1)A的化学式为,C的电子式为。
(2)写出SCl2与氨反应的化学方程式:。
(3)亚硝酸钠和X固体在加热条件下(填“可能”或“不能”)发生反应,判断理由是。
(4)请设计检验物质X的实验方案:。