2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化 学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
① 煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污
染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)  =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)  =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可 达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。
A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;② 、
、 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
HmDm的电子式___________________。
C、D元素的非金属性强弱顺序为:________ _
将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:
_________________________________________________________________。
常温下,将等物质的量浓度的Hm-1E溶液和A的最高价氧化物对应的水化物溶液等体积混合,写出该反应的离子方程式。在该溶液中溶质中含有的化学键类型是
在A、B、C、E单质中,符合下列转化关系的是_____________(填元素符号)。
已知常见金属单质A有以下物质相互转化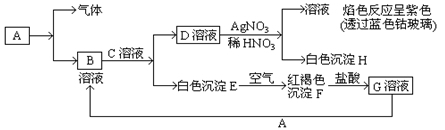
试回答:
(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)写出检验G溶液中的金属阳离子的试剂是(写化学式);向G溶液加入A的有关离子反应方程式。
已知:①A、B、C、D四种物质均含有元素X,有的还有可能含有元素Y、Z。且元素Y、X、Z的原子序数依次递增。②X在A、B、C、D四种物质中都不呈现其最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热分解,可制得元素Y的单质。试根据以上叙述回答:
(1)写出A、B、C、D的化学式::A_______B_______C_______D______。
(2)写出③、④中的两个化学方程式:
③,④ 。
如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则A的原子序数为_______,B为(填元素符号,下同)_____ ____,C为____________。
画出A的原子结构示意图:__________________,C的离子结构示意图:__________________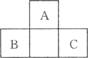
用电子式表示C的氢化物分子的形成过程:
(11分,最后一空为2分,其余各1分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 二 |
① |
② |
||||||
| 三 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 四 |
⑨ |
⑩ |
(1)在这些元素中,最易失电子的元素是 ,非金属性最强的元素是
(2)化学性质最不活泼的元素的原子结构示意图为
(3)元素的最高价氧化物对应的水化物中酸性最强的酸是,碱性最强的
碱是 呈两性的氢氧化物是;
(4)在③~⑦元素中,原子半径最大的是,原子半径最小的是 ;
(5)在⑦与⑩的单质中,氧化性强的是,可用什么化学反应说明该事实(写出反应的化学方程式):