根据碘与氢气反应的热化学方程式
(1)I2(g)+ H2(g) 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
(2)I2(s)+ H2(g) 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
| A.254 g I2(g)中通入2 gH2(g),反应放热9.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(2)的反应物总能量比反应(1)的反应物总能量低 |
| D.反应(1)的产物比反应(2)的产物稳定 |
图示为电解饱和食盐水的简易装置,下列有关说法正确的是()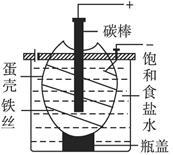
电解饱和食盐水简易装置
| A.电解一段时间后往蛋壳溶液中滴加几滴酚酞,呈红色 |
| B.蛋壳表面缠绕铁丝发生氧化反应 |
| C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝 |
| D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触 |
在盛有稀硫酸的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是()
A.正极附近的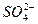 离子浓度逐渐增大 离子浓度逐渐增大 |
B.电子通过导线由铜片流向锌片 |
| C.正极有O2逸出 | D.铜片上有H2逸出 |
下列金属可用铝热法制备的是()
①铁 ②镁 ③锰 ④钒 ⑤铬
| A.①②④ | B.①②③⑤ |
| C.①③④⑤ | D.①②③④⑤ |
一种,新型燃料电池,一极通入空气,另一极通入丁烷气体,电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-。下列对该燃料的说法正确的是()
| A.在熔融电解质中,O2-由负极移向正极 |
| B.电池的总反应是:2C4H10+12O2====8CO2+10H2O |
| C.通入空气的一极是正极,电极反应为:O2+4e-====2O2- |
| D.通入丁烷的一极是正极,电极反应为:C4H10+26e-+13O2-====4CO2+5H2O |
下列各组金属最合适用氢气或CO把它们从化合物中还原出来的是()
| A.Ca、Mg | B.Al、Fe | C.Fe、Cu | D.Hg、Ag |