下列溶液中有关物质的量浓度关系正确的是
A.25 ℃时pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) + c(M+) = c(OH-) + c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH) < c(CH3COONa) < c(Na2CO3)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) + c(OH-) = c(H+) + c(CH3COOH)
D.0.1 mol·L-1的NaHA溶液,其pH=4: c(HA-) > c(H+) > c(H2A) > c(A2-)
关于氢键,下列说法正确的是
| A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键 |
| B.氯化钠易溶于水是因为形成了氢键 |
| C.氨易液化与氨分子间存在氢键无关 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。请填写下列空白:
[实验一]用如图所示装置,排水法收集一试管甲烷和氯气的混合气体,光照后观察到量筒内形成一段水柱,认为有氯化氢生成。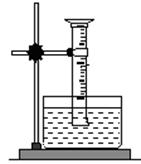
(1)该反应的化学方程式为;(只写第二步)
(2)水槽中盛放的液体最好为;(填标号)
| A.水 | B.饱和石灰水 | C.饱和食盐水 | D.饱和NaHCO3溶液 |
[实验二]用排蒸馏水法收集一试管甲烷和氯气的混合气体,光照反应后,
滴加AgNO3溶液,看到有白色沉淀生成,认为有氯化氢生成。
(3)该实验设计的错误之处
[实验三]步骤一:收集半试管氯气,加入10 mL 蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同)。测得pH = 3.26。
步骤二:收集一试管甲烷和氯气的混合气体(各占50%),在40 W的日光灯下光照6 min后,加入10 mL 蒸馏水,充分振荡,测得pH=1.00。(4)判断该反应中有氯化氢生成的依据是。
(5)假设氯气完全参与反应,且不考虑氯气溶解于水。往反应后的溶液中加水稀释到100.00 mL,取20.00 mL稀释液,加入10.00 mL浓度为0.01 mol·L-1的AgNO3溶液恰好完全反应,则试管中原有氯气在标准状况下的体积为mL。
在25℃时,将两个铂电极插入一定量的饱和Na2SO4溶液中电解,通电一段时间后,在阴极上逸出amol气体,同时有WgNa2SO4•10H2O晶体析出,若温度不变,此时剩余溶液的溶质的质量分数为
A.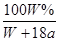 |
B. |
C. |
D. |
在一盛有饱和Na2CO3溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后()
| A.溶液的pH值增大;碳酸钠溶液的水解程度减小 | B.Na+和CO32—的浓度都减小 |
| C.阴极与阳极析出的气体物质的量之比为1:2 | D.溶液的浓度不变,有晶体析出 |
下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是()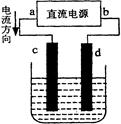
| A.a为负极、d为阳极 |
| B.将淀粉KI试纸的玻璃棒靠近d处一段时间会变蓝色 |
| C.电解过程中转移0.2mol电子,d电极质量增加6.4克 |
| D.电解过程中,铜离子向C极移动 |