碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
①2Al2O3(s)+2AlCl3(g)+6C(s) = 6AlCl(g)+6CO(g) ΔH=a kJ·mol-1
②3AlCl(g) = 2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
反应:Al2O3(s)+3C(s)=2Al(l)+3CO(g)的ΔH = kJ·mol-1 (用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) ΔH ="Q" kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间/min 浓度/mol/L |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.68 |
0.50 |
0.50 |
0.60 |
0.60 |
| N2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
| CO2 |
0 |
0.16 |
0.25 |
0.25 |
0.30 |
0.30 |
①0~10 min内,NO的平均反应速率v(NO)= ,T1℃时,该反应的平衡常数= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
A.通入一定量的NO B.加入一定量的活性炭
C.加入合适的催化剂 D.适当缩小容器的体积
③在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A.单位时间内生成2 n mol NO(g)的同时消耗n mol CO2(g)
B.反应体系的温度不再发生改变
C.混合气体的密度不再发生改变
D 反应体系的压强不再发生改变
有下列溶液①FeSO4、②MgCl2、③NH4NO3、④Na2SO4,分别加入A溶液可以将四种溶液鉴别出来。
(1)A可以是溶液;将A溶液加入FeSO4溶液中,现象是___________________;
将A溶液加入MgCl2溶液中,现象是_________________________________。
(2)写出NH4NO3溶液加入A溶液加热反应的离子方程式 _______________________。
以下有些结构简式,书写得不规范、不正确。请在它们后面打一个×号,并把你认为正确的写法写在后面。(注意:如果原式是允许的、正确的,请在后面打√就可以了)
(1)乙醇:HOCH2CH3;
(2)丙二醛:CHOCH2CHO;
(3)对甲苯酚: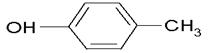 ;
;
(4)三硝基甲苯: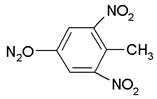 ;
;
(5)甲酸苯酯: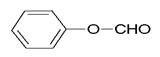 ;
;
(6)苯乙醛: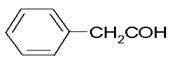 ;
;
某学生做浓硫酸性质的实验:在一支试管中放入一块很小的铜片,再加入2mL浓硫酸,然后把试管固定在铁架台上。把一小条蘸有品红溶液的滤纸放入带有单孔橡皮塞的玻璃管中。塞紧试管口,在玻璃管口处缠放一团蘸有Na2CO3溶液的棉花。加热试管,观察现象.回答下列问题: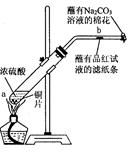
(1)写出试管中发生反应的化学方程式。
(2)试管中的液体反应一段时间后,b处滤纸条的变化为,待试管中反应停止后,给玻璃管放有蘸过品红溶液的滤纸处微微加热,滤纸条的变化为。
(3)蘸有Na2CO3溶液的棉花团作用是。
(4)硫酸型酸雨的形成过程可用下列反应中的来表示。
(5)浓硫酸有许多重要性质,在与含有水分的蔗糖作用过程中不能显示的性质是
| A.酸性 | B.脱水性 | C.强氧化性 | D.吸水性 |
已知某待测液由Ag+、Mg2+、K+、Ba2+、NH4+、NO3-中的若干种离子组成,进行如下实验:第一步:加入过量的稀盐酸,有白色沉淀生成。
第二步:过滤,在滤液中加入过量的稀硫酸,又有白色沉淀生成。
第三步:再过滤,取少量滤液,滴入NaOH溶液至溶液呈碱性,在此过程中溶液无明显现象,加热该溶液,可产生使湿润的红色石蕊试纸变蓝色的气体。
根据实验现象回答:
(1)写出第二步中所涉及的反应的离子方程式:
;
(2)待测液中一定含有、NO3-离子,一定不含有离子,还有一种离子不能确定其是否存在,要检验这种离子的实验方法是(填写实验名称和观察到的现象及结论,不要求写实验操作过程),。
现用Na2CO3固体配制500 mL 0.200 mol·L-1的Na2CO3溶液。可供选择的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤玻璃棒;⑥托盘天平;⑦漏斗。
请回答下列问题:
(1)上述仪器中,在配制Na2CO3溶液时不需要使用的有(填代号),还缺少的仪器是(写仪器名称)。
(2)经计算,需Na2CO3固体质量为。
(3)将所配制的Na2CO3溶液进行测定,发现浓度小于0.200 mol·L-1。请你分析配制过程中可能引起误差偏低的原因。
| A.定容时俯视液面 | B.配制时容量瓶没有干燥 |
| C.转移时没有洗涤烧杯和玻璃棒 | D.称量时砝码位置放错 |