下列实验的操作和结论正确的是
| A.将0.1 mol Na和少量 Al 片放入水溶液中,放出气体刚好是0.05 mol |
| B.Na2O2投入到 FeCl2溶液中只得到大量白色沉淀 |
| C.镁粉中混有铝粉,可与NaOH溶液反应再过滤,得到镁粉 |
| D.配制一定物质的量浓度溶液,定容时仰视容量瓶刻度线,使所得溶液浓度偏大 |
下列叙述正确的是
A.浓硫酸的装运包装箱应贴上如图所示的标识 |
| B.用25ml酸式滴定管量取20.00ml0.01 mol·L-1的Na2CO3溶液 |
| C.能使湿润的淀粉一碘化钾试纸变蓝的气体一定是Cl2 |
| D.从含I-的溶液中提取碘可以先加入稀硫酸与3%的H2O2溶液,再用酒精萃取 |
下列有关化学用语使用正确的是
A.硫原子的原子结构示意图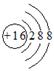 |
| B.乙烯的结构简式CH2CH2 |
| C.NaHSO4在熔融状态下的电离方程式:NaHSO4=Na++H++SO42- |
D.质子数为53,中子数为78的碘原子: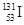 |
德国重离子研究中心于2010年2月19日宣布,以国际纯粹与应用化学联合会确认,由该中心合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”。选择2月19日为新元素正式冠名日,也是因为这一天是哥白尼的生日,有报道称Cn原子含有165个中子。下列有关112号元素的相关说法正确的是
A.该原子可表示为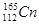 |
| B.该元素应位于元素周期表的第7周期ⅡB族 |
| C.该元素的相对原子质量为277 |
| D.该原子能够稳定存在 |
化学与生活、社会密切相关。下列说法正确的是
| A.红宝石、珍珠、玛瑙、水晶、钻石等装饰品的主要成分都是硅酸盐 |
| B.氢氧燃料电池、铅蓄电池、硅太阳能电池中都利用了原电池原理 |
| C.NO可用于某些疾病的治疗;SO2可用于食品防腐剂 |
| D.明矾可用于水的消毒、杀菌;硫酸钡可用于钡餐透视 |
右图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
| A.该试剂的物质的量浓度为9.2 mol/L |
| B.该硫酸50 mL若用5 mol/L的氢氧化钠中和,需要该氢氧化钠溶液100毫升 |
C.该硫酸与等体积的水混合所得溶液的质量分 数等于49% 数等于49% |
| D.配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL |