实验:①1 mol·L–1AgNO3溶液和0.1 mol·L–1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c; ②向滤液b中滴加0.1 mol·L–1KI溶液,出现浑浊; ③向沉淀c中滴加0.1 mol·L–1KI溶液,沉淀变为黄色。下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+ (aq)+Cl–(aq) Ag+ (aq)+Cl–(aq) |
| B.滤液b中不含有Ag+ |
| C.③中颜色变化说明AgCl 转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
下述实验设计合理的是
| 选项 |
实验目的 |
实验设计 |
| A |
检验溶液中是否含有Fe2+ |
向溶液中滴入氯水后,再滴加KSCN溶液 |
| B |
除去CO2中的HCl气体 |
通过饱和的NaHCO3溶液,然后干燥 |
| C |
除去乙酸乙酯中的乙酸 |
加入足量的NaOH溶液,然后分液 |
| D |
证明H2CO3酸性比H2SiO3强 |
Na2CO3和SiO2在高温下熔融反应 |
下列物质间的转化无法实现的是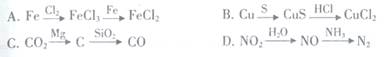
下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法不正确的是
| A.离子半径:d3+<f- |
| B.原子失电子能力:c>d |
| C.最简单气态氢化物的热稳定性:a<e |
| D.b、c两元素可组成既含离子键又含共价键的化合物 |
下列说法正确的是
| A.石油的分馏、煤的干馏、电解质溶液导电均属于物理变化 |
| B.做衣服的棉、麻、蚕丝的主要成分都是纤维素 |
| C.鸡蛋清中加人胆矾可以使蛋白质发生聚沉.加水后重新溶解 |
| D.乙烯和氯乙烯都可以通过加聚反应得到高分子化合物 |
化学来源于生活,服务于生活,下列有关叙述正确的是
| A.生活中钢铁制品生锈主要是由于吸氧腐蚀所致 |
| B.冰箱中使用的含氟制冷剂泄漏后,会增加空气中PM 2.5的含量 |
| C.氯气和活性炭均可作为漂白剂,同时使用可增强漂白效果 |
| D.明矾[KAl(SO4)2·12H2O]溶于水会形成胶体,因此可用于自来水的杀菌消毒 |