20 ℃ 时,将0.1 mol/L Na2S2O3溶液10mL 和 0.1 mol/L H2SO4溶液10mL混合,2 min 后溶液出现明显浑浊(发生的反应为Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O)。已知温度每升高10 ℃ ,该反应的化学反应速率增大到原来的2倍。那么50 ℃时,同样的反应要明显地出现浑浊,所需时间是
| A.48s | B.40s | C.20s | D.15s |
科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示)。已知该分子中N—N—N键角都是108.1°,下列有关N(NO2)3的说法正确的是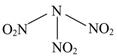
| A.分子中N、O间形成的共价键是非极性键 | B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 | D.15.2 g该物质含有6.02×1022个原子 |
下表列出了某短周期元素R的各级电离能数据(用I1、I2表示,单位为kJ·mol-1)。
| I1 |
I2 |
I3 |
I4 |
…… |
|
| R |
740 |
1 500 |
7 700 |
10 500 |
…… |
下列关于元素R的判断中一定正确的是
A、R的最高正价为+3价 B、R元素位于元素周期表中第ⅡA族
C、R元素的原子最外层共有4个电子 D、R元素基态原子的电子排布式为1s22s2
下列物质的沸点逐渐升高的是
| A.NH3 PH3 AsH3 SbH3 | B.Si SiC H2O CO2 |
| C.NaI NaBr NaCl NaF | D.Li Na K Rb |
下列说法中错误的是
| A.SO2、SO3都是极性分子 |
| B.在NH4+和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,含NA个氩原子的氩气的体积约为11.2 L |
| B.31g白磷分子中,含有的共价单键数目是NA个 |
| C.6 g金刚石晶体中含有的碳碳键数目为2×6.02×1023 |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |