与100mL0.1 mol·L—1AlCl3溶液中Cl—的物质的量浓度相等的是
| A.50mL0.1 mol·L—1NaCl溶液 | B.50mL0.15 mol·L—1MgCl2溶液 |
| C.10mL1.0 mol·L—1FeCl3溶液 | D.100mL0.3 mol·L—1KClO3溶液 |
在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是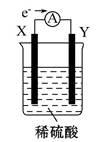
| A.外电路的电流方向为X→外电路→Y |
| B.若两电极分别为铁和碳棒,则铁棒进行的电极反应式为2H++2e-=H2↑ |
| C.X极上发生的是还原反应,Y极上发生的是氧化反应 |
| D.若两电极都是金属,则它们的活动性顺序为X>Y |
下列化学用语的表达正确的是:
| A.NaHSO3在溶液中的电离:NaHSO3=Na++H++SO32- |
B.Cl-的结构示意图 |
| C.HClO结构式:H-Cl-O |
| D.医用钡餐的化学式:BaSO4 |
下表是几种电解质的电离常数(25℃) 电解质的强弱判断正确的是
电解质的强弱判断正确的是
| A.e最弱 |
| B.b最强 |
| C.由强到弱的顺序为a> b> d >e >c |
| D.无法确定 |
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。正确的是
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。正确的是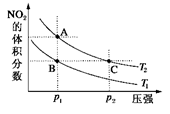
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C. A、C两点气体的平均相对分子质量:A>C
D.由状态B到状态A,可以用加热的方法
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol.若在该容器中开始时充入2.0molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)="1.2mol" |
| B.若为定容容器,n(NH3)>1.2mol |
| C.若为定压容器,n(NH3)>1.2mol |
| D.若为定压容器,n(NH3)<1.2mol |