(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液 的pH |
| a |
0.1 |
0.1 |
pH=9 |
| b |
c |
0.2 |
pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁。其生产工艺流程如下: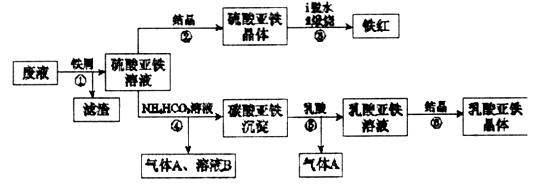
已知:①TiOSO4可溶于水,在水中可以电离为Ti02+和SO4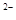 :
:
②TiOSO4水解的反应为: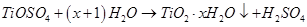
请回答:
(1)步骤①所得滤渣的主要成分为______________________________。
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为__________________。
(3)步骤④需控制反应温度低于35℃,其目的是___________________。
(4)步骤④反应的离子方程式是__________________________________。
(5)已知: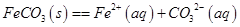 ,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
,试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_________________________________________________________。
(6)溶液B常被用于电解生产(NH4)2S208(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________________________________。
(7)Fe3+对H2O2的分解具有催化作用。利用下图(a)和(b)中的信息,按图(c)装置(连通的A、B瓶中已充有NO2气体)进行实验。可观察到B瓶中气体颜色比A瓶中的_________(填“深”或“浅”),其原因是_________________________________。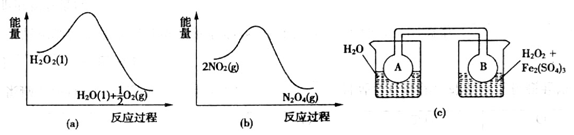
(1)利用H2S废气制取氢气的方法有多种。
①高温热分解法:已知: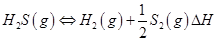 在恒容密闭容器中,控制不同温度进行H2S分解实验。
在恒容密闭容器中,控制不同温度进行H2S分解实验。
以H2S起始浓度均为c mol/L测定H2S的转化率,结果见图。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。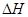 _____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
_____________0(填>,=或<):说明随温度的升高,曲线b向曲线a靠近的原因: _____________________。
②电化学法
该法制氢过程的示意图如图。反应池中反应的离子方程式是___________________;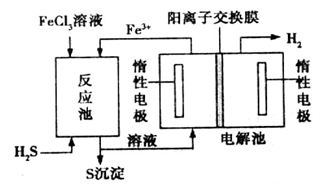
反应后的溶液进入电解池,电解总反应的离子方程式为________________。
(2)以Al和NiO(OH)为电极,NaOH溶液为电解液可以组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2。
①该电池的负极反应式_______________________________________________。
②电池总反应的化学方程式_________________________________________________。
(3)某亚硝酸钠固体中可能含有碳酸钠和氢氧化钠,现测定亚硝酸钠的含量。
已知:5NaNO2+2KMnO4+3H2SO4=5NaNO3+2MnSO4+K2SO4+3H2O
称取4.000g固体,溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol/L,酸性KmnO4溶液进行滴定,实验所得数据如下表所示;
| 滴定次数 |
1 |
2 |
3 |
4 |
| KMnO4溶液体积/mL |
20.60 |
20.02 |
20.00 |
19.98 |
①滴入最后一滴酸性KMnO4溶液,溶液__________________________,30秒内不恢复,可判断达到滴定终点。
②第一组实验数据出现异常,造成这种异常的原因可能是____________(填序号)。
A.酸式滴定管用蒸馏水洗净后未用标准液润洗
B.锥形瓶洗净后未干燥
C.滴定终了仰视读数
③根据表中数据,计算所得固体中亚硝酸钠的质量分数_____________。
(选考)【化学—选修5:有机化学基础】
有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下: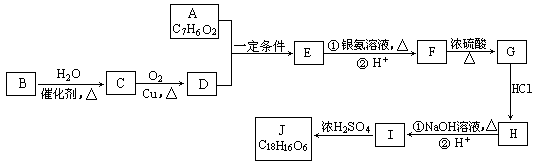
已知:
①A既能发生银镜反应,又能与FeCl3溶液发生显色反应,其核磁共振氢谱显示有4种氢,且峰面积之比为1︰2︰2︰1。
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③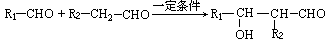
回答以下问题:
(1)A中含有的官能团名称是。
(2)写出有机反应类型B→C,F→G,I→J。
(3)写出F生成G的化学方程式。
(4)写出J的结构简式。
(5)E的同分异构体有多种,写出所有符合以下要求的E的同分异构体的结构简式。
①FeCl3溶液发生显色反应
②能发生银镜反应
③苯环上只有两个对位取代基
④能发生水解反应。
(选考)【化学—选修3:物质结构与性质】CuSO4在活化闪锌矿(主要成分是ZnS)方面有重要作用,主要是活化过程中生成CuS、Cu2S等一系列铜的硫化物活化组分。
(1)Cu2+基态的电子排布式可表示为;
(2)SO42-的空间构型为(用文字描述);中心原子采用的轨道杂化方式是;写出一种与SO42-互为等电子体的分子的化学式:;
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为;
(4)资料显示ZnS为难溶物,在活化过程中,CuSO4能转化为CuS的原因是。
(5)CuS比CuO的熔点(填高或低),原因是。
(6)闪锌矿的主要成分ZnS,晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_____(列式并计算),a位置S2-离子与b位置Zn2+离子之间的距离为_____pm(列式表示)。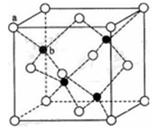
(选考)【化学一一化学与技术】氯碱工业是最基本的化学工业之一,离子膜电解法为目前普遍使用的生产方法,其生产流程如下图所示: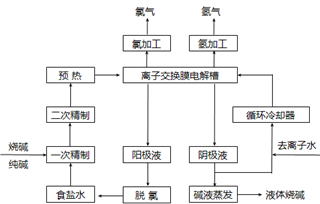
(1)该流程中可以循环的物质是。
(2)电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有Ca2+、Mg2+、SO42-等无机杂质,所以在进入电解槽前需要进行两次精制,写出一次精制中发生的离子方程式,若食盐水不经过二次精制就直接进入离子膜电解槽会产生什么后果。
(3)下图是工业上电解饱和食盐水的离子交换膜电解槽示意图(阳极用金属钛网制成,阴极由碳钢网制成)。则B处产生的气体是,E电极的名称是。电解总反应的离子方程式为。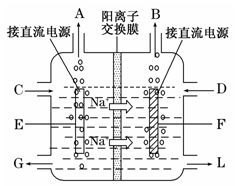
(4)从阳极槽出来的淡盐水中,往往含有少量的溶解氯,需要加入8%~9%的亚硫酸钠溶液将其彻底除去,该反应的化学方程式为。
(5)已知在电解槽中,每小时通过1安培的直流电可以产生1.492g的烧碱,某工厂用300个电解槽串联生产8小时,制得32%的烧碱溶液(密度为1.342吨/m3)113m3,电解槽的电流强度1.45 ×104A,该电解槽的电解效率为。