将下图所示实验装置的K闭合,下列判断正确的是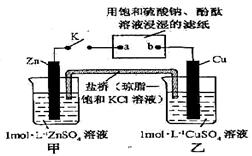
A.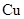 电极上发生还原反应 电极上发生还原反应 |
B.电子沿Zn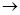 a a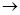 b b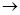 Cu路径流动 Cu路径流动 |
| C.片刻后甲池中c(SO42—)增大 |
| D.片刻后可观察到滤纸b点变红色 |
关于乙烯分子中的共价键,下列描述正确的是
| A.含有5个σ键、1个π键 |
| B.C-H之间是碳的sp2杂化轨道与H的s轨道形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键 |
| C.只有sp2杂化轨道才形成π键 |
| D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的σ键 |
氯原子M能层含有的轨道数为
| A.4 | B.5 | C.7 | D.9 |
氢元素形成的化合物种类众多,在下列化合物中,氢元素显示正价的是
| A.BH3 | B.SiH4 | C.C2H2 | D.NaH |
基态原子的第一电离能处于B、N之间的元素有
A.1种 B.2种 C.3种 D.4种
原子核外电子排布式为[Ar] 3d54s2的元素是
| A.Cr | B.ds 区元素 | C.ⅡA族元素 | D.ⅦB族元素 |