在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液生成沉淀的量与滴入NaOH溶液的体积关系如图所示则原混合溶液中Al2(S04)3与MgSO4的物质的量浓度之比为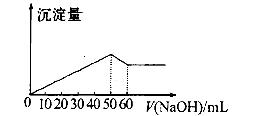
| A.6:1 | B.3:1 | C.2:1 | D.1:2 |
常温下,下列各组离子在指定溶液中能大量共存的是()
| A.无色透明的溶液中:MnO4-、SO42-、K+、Fe2+ |
| B.pH=1的溶液中:NH4+、Na+、SO42-、Fe3+ |
| C.含有大量AlO2-的溶液中:K+、Al3+、Br-、HCO3- |
| D.水电离产生的c(H+)=1×10-14mol·L-1的溶液中:HCO3-、NH4+、Cl-、Ca2+ |
将a L(标准状况)CO2通入100mL 3mol·L-1 NaOH溶液中,下列各项为通入CO2过程中溶液内发生反应的离子方程式,其中不正确的是()
| A.a =3.36时,CO2 + 2OH- = CO32- + H2O |
| B.a =4.48时,2CO2 + 3OH- = CO32- + HCO3- + H2O |
| C.a =6.72时,CO2 + OH- = HCO3- |
| D.a =8.96时,3CO2 + 4OH- = CO32- + 2HCO3- + H2O |
下列离子方程式表示正确的是()
| A.AgNO3溶液中加入Cu:Cu + Ag+ = Cu2+ + Ag |
| B.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42—+Ba2++OH—=BaSO4↓+H2O |
| C.甲酸溶液滴到大理石台板上有气泡产生:2H+ + CaCO3 = CO2↑+ Ca2+ + H2O |
| D.等体积等物质的量浓度的NaHCO3和Ba(OH)2溶液混合: |
HCO3- + Ba2+ + OH- = BaCO3↓+ H2O
若NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
| A.16g CH4与18 g NH4+所含质子数相等 |
| B.1mol 苯分子中含有碳碳双键数为3NA |
| C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22. 4L |
| D.7.8 g Na2O2中含有的离子总数目为0.3NA |
某同学在实验报告中记录下列数据,其中正确的()
| A.用 25mL 量筒量取 18.63mL 盐酸 |
| B.用托盘天平称取 12.15克食盐 |
| C.用标准的 NaOH 溶液滴定未知浓度的盐酸,用去 NaOH 溶液32.30mL |
| D.用 pH 试纸测得某溶液 pH 为 5.0 |