结合下图判断,下列叙述正确的是
| A.I和Ⅱ中正极均被保护 |
| B.I和Ⅱ中负极反应均是Fe-2e-=Fe2+ |
| C.I和Ⅱ中正极反应均是O2+2H2O+4e-=4OH- |
| D.I和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀 |
恒温、恒压下,在容积可变的密闭容器中通入1molX和1molY,发生反应 X(g)+Y(g)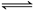 Z(g),达到平衡后生成amolZ,下列说法错误的是
Z(g),达到平衡后生成amolZ,下列说法错误的是
| A.达到平衡时-v正(Y)=-v逆(Z) |
| B.若向平衡混合物中充入氦气,平衡向左移动 |
| C.若最初向容器中通入的是3molX和3molY,达平衡后Z的物质的量分数为 |
| D.若最初向容器中通入的是3molX、2molY、1molZ,达平衡后容器中n(Z)<3amol |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1molC10H22分子中共价键总数为31NA |
| B.18 g2H2O中所含的电子总数为10NA |
| C.24 g NaH中阴离子所含电子总数为NA |
| D.标准状况下,11.2 LCO2和O2混合气体中含有的氧原子数为2NA |
X、Y、Z、W都是元素周期表中前20号元素,它们的原子序数依次增大。已知:
①W的阳离子和Z的阴离子具有相同的核外电子排布,且能形成组成为WZ的化合物;
②Z和Y属同族元素,它们能形成两种常见化合物;
③X和Y属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Z不在同一周期,它们能形成组成为XZ2的化合物。
下列说法不正确的是
A.XY2是以极性键结合成的非极性分子  |
| B.XY2、XZ2的化学键类型和晶体类型都相同 |
| C.WY、ZY2分子中所有原子最外层都为8电子结构 |
| D.离子半径大小顺序为Y<W<Z |
高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价可看作部分为0价,部分为-2价。该晶体中的最小重复单元结构如下图所示,则下列说法错误的是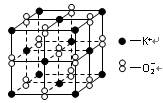
| A.超氧化钾的化学式为KO2 |
| B.晶体中与每个K+距离最近的K+有4个 |
| C.晶体中每个K+周围有6个O-2,每个O-2周围有6个K+ |
| D.晶体中,0价氧与-2价氧的原子数目比可看成是3∶1 |
化学与生活、社会密切相关。下列叙述不正确的是
| A.改液化石油气为天然气作燃料,燃烧时应减小进空气量或增大进天然气量 |
| B.制造生活中的水杯、奶瓶、食物保鲜膜等,使用聚乙烯材料比聚氯乙烯更有利于健康 |
| C.光导纤维导电能力很强,是一种很好的通讯材料 |
| D.绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应 |