实验①0.1 mol·L-1AgNO3溶液和0.1 mol·L-1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀C;②向滤液b中滴加0.1 mol·L-1KI溶液,出现浑浊;③向沉淀C中滴加0.1 mol·L-1KI溶液,沉淀变为黄色。
下列分析不正确的是
A.浊液a中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+C1-(aq) Ag+(aq)+C1-(aq) |
| B.滤液b中不含Ag+ |
| C.③中颜色变化说明AgCl转化为AgI |
| D.实验可以证明AgI比AgCl更难溶 |
可以证明可逆反应N2+3H2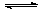 2NH3已达到平衡状态的是:
2NH3已达到平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂
②一个N≡N键断裂的同时,有6个N-H键断裂
③其它条件不变时,混合气体平均式量不再改变
④保持其它条件不变时,体积压强不再改变
⑤NH3%、N2%、H2%都不再改变
⑥恒温恒容时,密度保持不变
⑦正反应速率v(H2)=0.6mol/L·min,逆反应速率v(NH3)=0.4mol/L·min
⑧υ正(N2)=υ逆(NH3)
⑨2υ正(H2)=3υ逆(NH3)
| A.全部 | B.只有①③④⑤⑨ |
| C.②③④⑤⑦⑨ | D.只有①③⑤⑥⑦ |
在2L的密闭容器里充入4molN2和6molH2,在一定条件下使其反应,5min后测得反应混合物中NH3占25%(体积分数),则此时用氮气表示反应速率为( )mol/Lmin
A 0.05 B 0.1 C 0.125 D 0.25
强酸和强碱的稀溶液的中和热可表示为:
H+(aq)+OH-(aq)=H2O(1)△H =-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O△H ="-" Q1kJ/mol
1/2 H2SO4(浓) + NaOH(aq) ="=" 1/2Na2SO4(aq) +H2O(1)△H ="-" Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1)△H ="-" Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的绝对值大小的关系为( )
| A.Q1=Q2=Q3 | B.Q2>Q1>Q3 | C.Q2>Q3>Q1 | D.Q2=Q3>Q1 |
2008年北京奥运会“祥云”奥运火炬所用环保型燃料为丙烷,悉尼奥运会所用火炬燃料为65%丁烷和35%丙烷,已知丙烷的燃烧热为2221.5 kJ·mol-1;正丁烷的燃烧热为2878 kJ·mol-1;异丁烷的燃烧热为2869.6 kJ·mol-1;下列有关说法正确的是
| A.丙烷燃烧的热化学方程式:C3H8(g)+5O2(g)=3CO2(g)+4H2O(g)ΔH=-2221.5 kJ/mol-1 |
| B.相同质量的正丁烷和丙烷分别完全燃烧,前者需要的氧气多,产生的热量也多 |
C.正丁烷 比异丁烷稳定 比异丁烷稳定 |
| D.奥运火炬燃烧时主要是将化学能转变为热能和光能 |
用铁片与稀硫酸反应制取氢气时,下列措施能使制取氢气生成速率加大的是:
| A.降温 | B.不用稀硫酸,改用98%浓硫酸 |
| C.不用稀硫酸,改用稀硝酸 | D.滴加少量CuSO4溶液 |