以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
| 离子 |
开始沉淀pH |
沉淀完全pH |
| Fe2+ |
7.6 |
9.6 |
| Fe3+ |
2.7 |
3.7 |
| Zn2+ |
5.4 |
8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式 。
(2)步骤2中调节溶液pH的范围是 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。
MMA既是一种高分子化合物(有机玻璃)的单体,又是制取甲基丙烯酸丙酯等的重要原料。现有三条制备高分子(MMA)的途径,其流程下如:
(1)工业上将A和甲醇及过量硫酸一起,一步反应生成MMA,该反应的化学方程式为
_________。
(2)反应②是在500℃并有催化剂存在的条件下发生的,则其反应类型为:。
(3)某物质既能发生银镜反应,又能发生水解反应,其分子中还有手性碳原子,并与 互为同分异构体,则其物质结构简式为:____。
互为同分异构体,则其物质结构简式为:____。
(4)物质D的核磁共振氢谱有两个峰,它与CO、CH3OH以物质的量之比1︰1︰1反应恰好生成MMA,则D的结构简式为__________,该方法的优点是______。
(5)MMA和1-丙醇反应制取甲基丙烯酸丙酯的化学方程式为:____________。
(6)根据题中流程里提供的新信息,写出由(CH3)2C=CH2制备化合物
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下: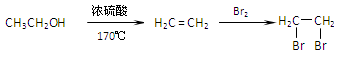
下图中的反应①是重要的电化学工业反应,反应②可用于制备新型消毒净水剂Na2FeO4。常温下B、C为气态单质,G是当代社会使用量最大的金属,其余均为化合物。(反应时加入或生成的水,以及生成沉淀I时的其他产物均已略去) 。
请回答下列问题:
(1)L的电子式为_______________。
(2)J溶液蒸干灼烧得到的物质是(填化学式) _______________。
(3)反应①的化学方程式是____________________________________。
(4)反应②的离子方程式是____________________________________。
(5)Na2FeO4能起到消毒净水的原理是。(用文字叙述)
聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有_______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是_________________。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
过渡元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)原子序数小于36的过渡元素A和B,在周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。请写出B元素在周期表中的位置为,A2+在基态时外围电子(价电子)排布式为。
(2)氯化铬酰(CrO2Cl2)熔点:-96 .5℃,沸点:117℃,能与CH3COCH3(丙酮)、CS2等互溶。则固态CrO2Cl2属于晶体。已知CS2与NO2+互为等电子体,则1mol NO2+中含有π键数目为。
(3)二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、二氧化碳及水说法正确的是。
a.水的沸点比甲醛高得多,是因为水分子间能形成氢键
b.甲醛、苯和二氧化碳中碳原子均采用sp2杂化
c.苯、二氧化碳是非极性分子,水和甲醛是极性分子
(4)Co3+有多种配合物,如Co(CN)63-、Co(NH3)4Cl2+等。铑(Rh)与钴属于同族元素,某些性质相似。现有铑的某盐组成为CsRh(SO4)2·4H2O,易溶解于水,向其水溶液中加入一定浓度的BaCl2溶液,无沉淀生成。请写出该盐溶解于水后的电离方程式:。
研究NO2、SO2、CO等大气污染气体的测量及处理具有重要意义。
(1)I2O5可使H2S、CO、HC1等氧化,常用于定量测定CO的含量。已知:
2I2(s) + 5O2(g)= 2I2O5(s)△H=-75.56 kJ·mol-1
2CO(g) + O2(g)= 2CO2(g)△H=-566.0 kJ·mol-1
写出CO(g)与I2O5(s)反应生成I2(s)和CO2(g)的热化学方程式:。
(2)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO2的同时生成1 molNO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=。
(3)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为(写出一种即可)。
(4)如图是一种碳酸盐燃料电池(MCFC),以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出B极电极反应式。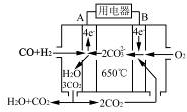
(5)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
①用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4L(标准状况)CO2(全部逸出)时,吸收液质量就增加44g,则混合气体中NO和NO2的体积比为。
②用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是。