某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是( )
| A.H2SO4浓度为2.5 mol·L-1 |
| B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
| C.第二份溶液中最终溶质为FeSO4 |
| D.混合酸中NO3-物质的量为0.4mol |
关于有机物的描述正确的是
| A.有机物是有生命的物质 |
| B.有机物只能由动植物体内产生,不能用人工方法合成 |
| C.凡是含碳元素的化合物都属于有机物 |
| D.在所有的有机物中都含有碳,多数含有氢,其次还含有氧、氮、卤素、硫等 |
下列有关电解质溶液的推理中正确的是
| A.室温下,pH=4的醋酸和pH=10的氢氧化钠溶液等体积混合,其pH> 7 |
| B.pH=3的盐酸与pH=11的氨水等体积混合后,溶液中: c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C.物质的量浓度相等的NH4Cl溶液和NH4HSO4溶液中,NH4+浓度相等 |
D.在有AgI沉淀的上清液中滴加 NaCl溶液,可以观察到白色沉淀产生 NaCl溶液,可以观察到白色沉淀产生 |
美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,获得了2010年诺贝尔化学奖。钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有:CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法不正确的是
| A.反应中转移的电子为1 mo1时,生成 2mo1物质X |
| B.未知物质X为CO2 |
| C.反应中CO作还原剂 |
| D.题述反应条件下还原性:CO> Pd |
瓦斯爆炸是煤矿开采中的重大危害,一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷浓度达到一定浓度时,可以通过传感器显示。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。

甲乙
下列有关叙述正确的的是
| A.瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a |
| B.电极b是正极,O2-由电极a流向电极b |
| C.电极a的反应式为:CH4+4O2—―8e-=CO2 +2H2O |
| D.当固体电解质中有1 mol O2-通过时,电子转移4 mol |
T ℃时,在1 L的密闭容器中充入2 mol CO2和6 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) 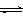 CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g)△H=-49.0 kJ·mol-1
测得H2和CH3OH(g)的浓度随时间变化如下图所示。下列说法不正确的是
| 时间 |
c(H2)/mol·L-1 |
c(CH3OH)/mol·L-1 |
v(正)和v(逆) 比较 |
| t0 |
6 |
0 |
? |
| t1 |
3 |
1 |
v(正)=v(逆) |
| A.t0~t1时间内υ(H2)=3 /(t1 - t0) mol·(L·min)-1 |
| B.t1时,若升高温度或再充入CO2气体,都可以提高H2的转化率 |
| C.t0时,v(正)>v(逆) |
| D.T ℃时,平衡常数K = 1/27,CO2与H2的转化率相等 |