分碳和氮的许多化合物在工农业生产和生活中有重要的作用。
(1)工业上生产硝酸所需要的一氧化氮常用氨气来制备,该反应的化学方程式为 。
(2)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2 NH4(s) △H="-l59.5" kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H="+116.5" kJ·mol-1
③H2O(1)=H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式
(3)以氨气代替氢气研发氨燃料电池是当前科研的一个热点,已知氨燃料电池使用的电解质溶液是2mol·L-1的KOH溶液,电池反应为:4NH3+3O2=2N2+6H2O。该电池负极的电极反应式为 ;每消耗3.4g NH3转移的电子数为 (阿伏加德罗常数的值用NA表示)。
(4)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1。
N2(g)+CO2(g) △H="Q" kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(Min) 浓度(mol·L-1) |
0 |
10 |
20 |
30 |
40 |
50 |
| NO |
1.00 |
0.58 |
0.40 |
0.40 |
0.48 |
0.48 |
| N2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
| CO2 |
0 |
0.21 |
0.30 |
0.30 |
0.36 |
0.36 |
①T1℃时,该反应的平衡常数K= ;
②30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 (填字母编号)。
a.加入一定量的活性炭 b.通人一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则Q 0(填“>”或“<”)。
下图是部分常见元素的单质及其化合物的转化关系图(有关反应的条件及生成的部分产物已略去)。已知:E为红棕色固体,K为浅绿色溶液;反应②是化工生产中的重要反应;B、C、D、H是单质;B、C、D、F、G、H常温下是气态; F、P 和H的水溶液均具有漂白作用,且F是形成酸雨的主要物质之一;N是一种常见的氮肥;化合物G为常见的致冷剂,化合物M由两种元素组成,分子内共有58个电子。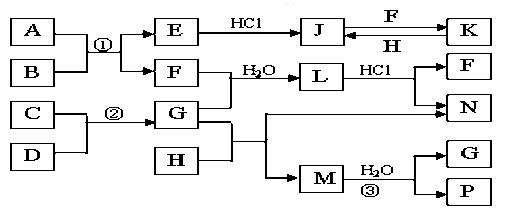
(1)化合物A中含有的两种元素是 (写元素符号)M的化学式_______
(2)如何检验化合物N中的阳离子
(3)写出K与H反应的离子方程式:
C与D反应的化学方程式:
(4)等物质的量F和H的混合气体通入品红溶液中的现象为 ,原因是(用离子反应方程式表示)
(5)实验中可用NaOH溶液来吸收多余的H,请写出此离子反应方程式
(2分)
某化学课外小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题:
(1)写出装置A中主要反应的化学方程式(2分)
(2)如何检查装置A的气密性(2分)
(3)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,写出该反应的热化学方程式(2分)
该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是________(2分)
| A.升高温度 | B.降低温度 | C.增大压强 | D.增大压强 |
(4)实验结束后,关闭止水夹b、c,将装置D,浸入冰水中,现象是______(2分)
(5)装置C中浓H2SO4的作用是(2分)
(6)请你帮助该化学小组设计实验室制取NH3的另一方案(用化学反应方程式表示)
物质的转化关系如下图所示,其中甲可由两种单质直接化合得到,乙为金属单质,
F的溶液中只含一种溶质,G为酸,乙在G的浓溶液中发生钝化。若用两根玻璃棒分别蘸取A、G的浓溶 液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
液并使它们接近,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。则
(1)①反应的化学方程式是 。
(2)②③两步反应的离子方程式分别是,
。
(3)在④的反应中,每1molE参加反应,将会有 mol电子发生转移。
现有A、B、C、D、E五种盐溶液,分别由 、
、 、
、 、
、 、
、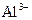 、
、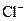 、
、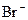 、
、 、
、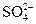 、
、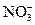 中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓ ④D+C→白↓ ⑤A溶液中
中的阳离子和阴离子各一种组成(五种盐所含阴、阳离子各不相同).已知:①A+B→白↓ ②A+D→白↓ ③B+C→白↓ ④D+C→白↓ ⑤A溶液中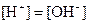 ⑥B溶液中
⑥B溶液中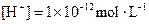 ⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用化学式表示)A为___________________;B为__________________;C为______________
⑦C、D、E三种溶液的pH<7,根据以上实验事实可以推出(用化学式表示)A为___________________;B为__________________;C为______________ _____;D为__________________;E为___________________.
_____;D为__________________;E为___________________.
写出以上各步反应的离子方程式:
①_________________________________________________________________________
②_________________________________________________________________________
③_________________________________________________________________________
(1)1.01×105 Pa,273℃时气态单质Xn的密度为d g/L,则X的相对原子质量为_________________。
(2)相同状况下,一定体积的X的气态氢化物HmX的质量是等体积NH3的2倍。则X的相对原子质量为_______________________________。
(3)a个X原子的总质量为b g,则X的相对原子质量可表示为____________________。
(4)标准状况下,1体积水可以溶解700体积氨气,所得溶液的密度为0.90 g·cm-3,则所得氨水的物质的量浓度为__________________。
(5)已知98%的浓H2SO4溶液的物质的量浓度为18.4 mol/L,试判断49%的H2SO4溶液的物质的量浓度______(“大于”“小于”或“等于”)9.2 mol/L