下列事实中不能证明 是弱电解质的是
是弱电解质的是
A.常温下某 |
B.常温下0.1mol 溶液的pH=2.8 溶液的pH=2.8 |
C. 溶液与稀盐酸反应生成 溶液与稀盐酸反应生成 |
D. 属于共价化合物 属于共价化合物 |
美国加州Miramal海军航空站安装了一台250kW的MCFC型燃料电池,该电池可同时供应电和水蒸气,其工作温度为600℃~700℃,所用燃料为H2,电解质为熔融的K2CO3。该电池的总反应为:2H2+O22H2O,负极反应为:H2+CO32-→H2O+CO2+2e-。
则下列推断中,正确的是
| A.正极反应为4OH—→2H2O+O2+4e-↑ |
| B.当电池生成1mol水时,转移4mol电子 |
| C.放电时CO32-向负极移动 |
| D.放电时电子向负极移动 |
物质的量浓度都为0.1mol·L-1的CH3COOH与NaOH溶液等体积混合后,下列关系式不正确的是
| A.[Na+]+[H+]=[OH-]+[CH3COO-] |
| B.[Na+]>[CH3COO-]>[H+]>[OH-] |
| C.[OH-]=[H+]+[CH3COOH] |
| D.[CH3COOH]+[CH3COO-]=[Na+] |
一定温度下,氢氧化镁饱和溶液中存在如下关系:c(Mg2+)·[c(OH-)]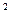 =Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
=Ksp,其中Ksp为常数,称为该温度下Mg(OH)2的溶度积常数。试推断氢氧化镁在下列物质中的溶解度由大到小的顺序是
① 0.1mol·L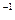 AlCl3溶液② 0.1mol·L
AlCl3溶液② 0.1mol·L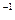 NH4Cl溶液
NH4Cl溶液
③ 0.1mol·L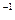 KCl溶液④ 0.1mol·L
KCl溶液④ 0.1mol·L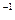 K[Al(OH)4]溶液
K[Al(OH)4]溶液
| A.①④③② | B.①②③④ | C.③①④② | D.④①③② |
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
| A.向水中加入氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
对于可逆反应2AB3(g)  A2(g)+3B2(g) ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是
A2(g)+3B2(g) ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是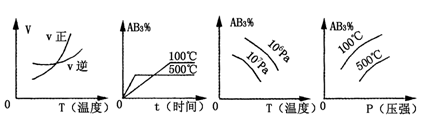
A B C D