某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液肯定不存在的离子组是
| A.Al3+、Mg2+、SO32- | B.Mg2+、CO32-、I- |
| C.Al3+、SO32-、I- | D.Al3+、Br-、SO32- |
下列离子方程式与所述事实相符且正确的是
| A.向CuSO4溶液中滴加过量的氨水:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+ |
| B.向NaAlO2溶液中通入过量CO2: 2AlO2-+CO2+3H2O =2Al(OH)3↓+CO32- |
| C.用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+=Cu2++2H2O |
| D.用FeS除去工业废水中的Hg2+:Hg2++S2- =HgS↓ |
设NA表示阿伏加德罗常数的值,下列说法正确的是
| A.电解精炼铜时,阳极质量每减少32g,阴极上生成Cu原子数约为0.5×6.02×1023 |
| B.标准状况下,22.4LNO和11.2L氧气混合,原子总数 为3NA个,分子总数约为1.5NA个, |
| C.28 g N60单质(见图)中含有的N—N键键数为3NA |
| D.1molNa2CO3晶体中含有阴离子数为NA 个 |

某温度时,在体积为1L的密闭容器中,A、B、C三种气体浓度的变化如图I所示,若其它条件不变,当温度分别为Tl和T2时,B的体积百分含量与时间关系如图II所示。则下列结论正确的是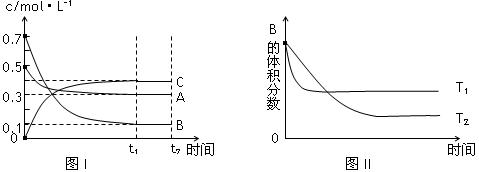
A.该反应的热化学方程式为:A(g )+3B(g) 2C(g) ;△H>0
2C(g) ;△H>0
B.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
C.达到平衡后,若其他条件不变,减小体积,平衡向正反应方向移动
D.若其它条件不变,升高温度,正、逆反应速率均增大,A的转化率减小
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、 W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是
| A.Y、Z和W三种元素不可能位于同一周期 |
| B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
| C.Y和W所形成的含氧酸均为强酸 |
| D.X、Y、Z和W可形成X5YZ4W的离子化合物 |
X、Y、Z是三种常见元素的单质,甲、乙是两种常见的化合物,这些单质和化合物之间存在如图所示的转化关系,下列说法正确的是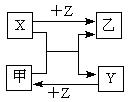
| A.X、Y、Z一定是非金属单质 |
| B.X、Y、Z中至少有一种是金属单质 |
| C.若X、Y都为金属单质,则Z必为非金属单质 |
| D.若甲为FeI2,则乙可能为FeCl2 |