已知H2S能定量完成下列反应:R- +H2S(少量) HR + HS-, 2Z-+ H2S(少量)
HR + HS-, 2Z-+ H2S(少量) 2HZ + S2-。下列叙述正确的是
2HZ + S2-。下列叙述正确的是
| A.相同温度下电离平衡常数:Ki1(H2S)>Ki(HZ)>Ki2(H2S)>Ki(HR) |
| B.结合H+的能力:Z->S 2->R->HS- |
| C.同温同浓度下,溶液的pH值:NaHS>NaR>Na2S>NaZ |
D.HZ与Na2S反应的离子方程式:HZ +S2- HS- + Z- HS- + Z- |
下列各项括号内为杂质,后面为除杂质操作,其中正确的是
| A.溴苯(液溴),加四氯化碳、萃取 |
| B.乙烷(乙烯),通入高锰酸钾溶液、洗气 |
| C.溴乙烷(乙醇),加水振荡、分液 |
| D.乙酸乙酯(乙酸),加氢氧化钠溶液振荡、分液 |
分子式为C3H4Cl2的链状化合物(包括顺反异构)有
| A.5种 | B.6种 | C.7种 | D.8种 |
根据下列事实所作的结论,正确的是
| 编号 |
事实 |
结论 |
| A |
甲、乙两种有机物具有相同的相对分子质量和不同结构 |
甲和乙一定是同分异构体 |
| B |
质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 |
甲、乙两种分子中,H原子个数一定相同 |
| C |
不存在两种二氯甲烷 |
CH2Cl2一定只有一种 |
| D |
将C2H5Br与NaOH醇溶液共热后的气体直接通入酸性KMnO4溶液,紫红色褪去 |
使KMnO4褪色的一定是C2H4 |
有8种物质:①乙烷;②乙烯;③乙炔;④苯;⑤甲苯;⑥溴乙烷;⑦聚丙烯;⑧环己烯。其中既不能使酸性KMnO4溶液褪色,也不能与溴水发生化学反应使溴水褪色的是
| A.①②③⑤ | B.④⑥⑦⑧ | C.①④⑥⑦ | D.②③⑤⑧ |
下列各物质中,互为同系物的是
A.CH3-CH2-CH2-CH3与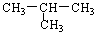 |
| B.C3H8与C6H14 |
| C.乙烯和1,3-丁二烯 |
| D.CH3CH2Cl 和CH2ClCH2CH2Cl |