800℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应
CO(g)+H2O(g) CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min |
n(CO)/mol |
n(H2O)/ mol |
| 0 |
1.20 |
0.60 |
| t1 |
0.80 |
|
| t2 |
|
0.20 |
下列说法正确的是
A.反应在t1min内的平均速率为v(H2)= mol/(L·min)
mol/(L·min)
B.保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2O,到达平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升至1000℃,上述反应平衡常数为1.6,则正反应为放热反应
已建立化学平衡的某可逆反应,当条件改变使化学平衡向正反应方向移动,下列叙述正确的是()
①生成物的质量分数一定增加;②生成物的物质的量一定增加;
③反应物的转化率 一定增大;④平衡时反应物的浓度一定降低;
一定增大;④平衡时反应物的浓度一定降低;
⑤正反应速率一定大于逆反应速率;⑥一定使用了催化剂;
| A.①②⑤ | B.④⑥ | C.②⑤ | D.③④⑤ |
控制合适的条件,将反应 ,设计成如图所示的原电池。下列判断不正确的是()
,设计成如图所示的原电池。下列判断不正确的是()
| A.反应开始时,乙中石墨电极上发生的电极反应式为 2I——2e—===I2 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中加入FeCl2固体,乙中石墨电极为负极 |
原子的核电荷数小于18个某元 素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2—1。下列有关X的说法中不正确的是()
素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2—1。下列有关X的说法中不正确的是()
| A.X能形成化学式为X(OH)3的碱 |
| B.X能与某些金属元素形成的化合物 |
| C.X原子的最外层电子数和核电荷数肯定为奇数 |
| D.X可能形成化学式为KXO3的盐 |
硫代硫酸钠溶液与稀硫酸反应的化学方程为:
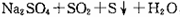 ,下列各组实验中最先出现浑浊是()
,下列各组实验中最先出现浑浊是()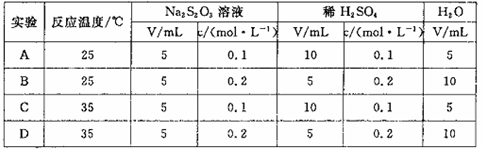
下列解释实验事实的方程式不正确的是()
A.0.1mol/LCH3COOH溶液的pH >1: >1: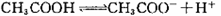 |
B.“NO2 平衡球”浸泡在冷水中,颜色变浅: 平衡球”浸泡在冷水中,颜色变浅: |
C.铁溶于稀硝酸,溶液变黄: |
D.向Na2 CO3溶液中滴入酚酞溶液,溶液变红: CO3溶液中滴入酚酞溶液,溶液变红: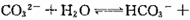  |