为探究Na2SO3溶液的性质,在白色点滴板的a、b、c、d四个凹槽中滴入Na2SO3溶液,再分别滴加下图所示的试剂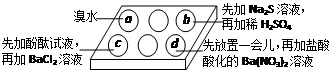
对实验现象的“解释或结论”错误的是
| 选项 |
实验现象 |
解释或结论 |
| A |
a中溴水褪色 |
还原性:SO32—> Br— |
| B |
b中加硫酸后产生淡黄色沉淀 |
SO32—和S2—在酸性条件下发生反应 |
| C |
c中滴入酚酞溶液变红,再加BaCl2溶液后产生白色沉淀且红色褪去 |
SO32—+H2O HSO3—+OH—,所以滴入酚酞变红; HSO3—+OH—,所以滴入酚酞变红;Ba2++SO32—→BaSO3↓(白),使水解平衡左移,红色褪去 |
| D |
d中产生白色沉淀 |
Na2SO3溶液已被氧化变质 |
天然气是植物残体在隔绝空气的条件下,经过微生物的发酵作用而逐渐形成的,因此天然气中所贮藏的化学能最初来自于
| A.化学能 | B.生物质能 | C.太阳能 | D.地热能 |
下列叙述正确的是
| A.一般来说,金属活动性越强的金属,人类大规模开发、利用的时间越早 |
| B.FeCl3溶液与Cu不会反应 |
| C.为减少高炉炼铁产生的污染,可以将烟囱造高一些 |
| D.根据酸碱质子理论,HCO3—也可归类为酸碱两性物质 |
节能减排是现阶段实现经济可持续发展的重大举措。下列举措不符合这一要求的是
| A.大力发展洁净煤燃烧技术和煤液化技术 |
| B.减少木材的使用,用聚苯乙烯生产包装盒、快餐盒 |
| C.农村大力发展沼气,将废弃的秸杆转化为清洁高效的能源 |
| D.推广使用乙醇汽油作汽车燃料 |
化学在自然资源的利用中具有重要的意义,下列对其认识不正确的是
| A.利用化学知识和化学规律,人们可以更好地开发和利用资源 |
| B.利用化学知识和化学规律,人们可以制取更多物质,丰富物质世界 |
| C.人们在利用资源的过程中,对环境造成了污染,化学对此无能为力 |
| D.人们对资源的开发和利用过程中,不能忘记可持续性发展 |
美国在科索沃战场上投下了至少10吨贫铀弹,贫铀弹的主要成分是低放射性的238U,它与制造原子弹的235U属于
| A.同位素 | B.同一物质 | C.同分异构体 | D.同素异形体 |