活性炭吸附法是工业提碘的主要方法之一。其流程如下: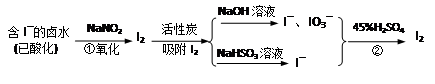
完成下列填空:
(1)酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
(2)氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
(3)反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
(4)流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
(5)流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3– + H2O H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
置换反应可用下图表示,回答下列问题: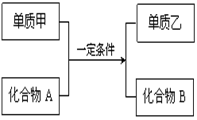
(1)若甲为黄绿色气体,单质乙能使淀粉溶液变蓝色,则该反应的离子方程式为
。
(2)若过量单质甲与化合物A发生反应的化学方程式为:2Al+Fe2O3 Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是,写出铝粉与所用试剂反应的离子方程式。
Al2O3+2Fe, 除去反应后混合物中剩余的铝粉与生成的Al2O3所用的试剂是,写出铝粉与所用试剂反应的离子方程式。
(3)工业上利用置换反应原理制备一种半导体材料,写出该反应的化学方程式
。
(4)若单质乙是黑色非金属固体单质,化合物B是优质的耐高温材料,则该反应的化学方程式为。
A~J及X均为有机化合物,它们之间的转化如下图所示:
 实验表明:①X的分子结构中无支链,链状二烯烃,D既能发生银镜反应,又能与金属钠反应放出氢气:
实验表明:①X的分子结构中无支链,链状二烯烃,D既能发生银镜反应,又能与金属钠反应放出氢气:
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1:1:1;
③G能使溴的四氯化碳溶液褪色;④1mol J与足量金属钠反应可放出22.4L氢气(标准状况)。
请根据以上信息回答下列问题: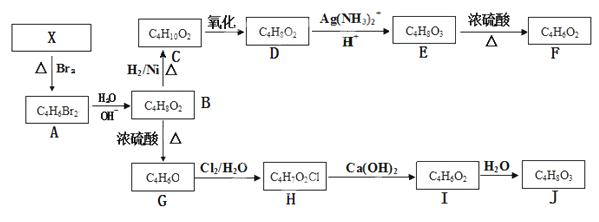
(1)X的结构简式为____________(不考虑立体结构),由X生成A的反应类型是____________反应;
(2)D的结构简式为_____________;
(3)由E生成F的化学方程式为_______________, E具有相同官能团的E的同分异构体还有________________(写出结构简式,不考虑立体结构);
(4)G的结构简式为_____________________;
(5)由I生成J的化学方程式______________。
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为(用元素符号表示)。
(3)Cu晶体的堆积方式是(填堆积名称),其配位数为;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
| A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键 |
| B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道 |
| C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素 |
| D.SO42-与PO43-互为等电子体,空间构型均为正四面体 |
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①H3BO3中B的原子杂化类型为;
②写出硼酸在水溶液中的电离方程式。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)
[化学-选修化学与技术]
七水硫酸镁(MgSO4·7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下: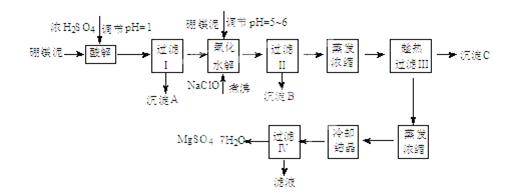
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的 Mn2+氧化成MnO2,反应的离子反应方程式为。加热煮沸的主要目的是。
(2)沉淀B中除MnO2、SiO2外还含有(填化学式)等物质。
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是;
(4)沉淀C的化学式是。过滤III需趁热过滤的理由是
甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
(1)反应②是(填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A)K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=(用K1、K2表示)。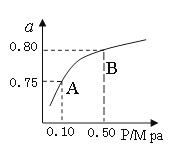
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼雷电池,其原理如图所示。该电池的负极反应式是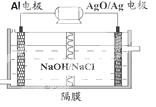
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为。