科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价砷类化合物。下列说法中不正确的是
| A.维生素C具有还原性 |
| B.上述过程中砷元素发生还原反应 |
| C.上述过程中+5价砷类物质作氧化剂 |
| D.1 mol+5价砷完全转化为+3价砷,共失去2 mol电子 |
下图是可逆反应X2(g)+ 3Y2(g) 4Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()
4Z2(g)在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是()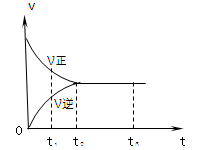
| A.t1时,只有正方向反应 | B.t2时,V正>V逆 |
| C.t2- t3,反应不再发生 | D.t2- t3,各物质的浓度不再发生变化 |
我国首创的海水电池以铝为负极,铂网为正极,海水为电解质溶液。空气中的氧气与铝反应产生电流,电池总反应为:4Al + 3O2+ 6H2O=4Al (OH )3,下列说法正确的是()
| A.电池工作时,电流由铝电极沿导线流向铂电极 |
| B.以网状的铂为正极,可增大与氧气的接触面积 |
| C.为了增加海水的导电性,向海水中加人大量食盐 |
| D.负极反应:O2+ 2H2O+ 4e-=4OH一 |
对于反应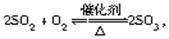 下列判断正确的是( )
下列判断正确的是( )
| A.2 mol SO2和足量的O2反应,必生成2 mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度必为O2浓度的2倍 |
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )
| A.原子半径:W>Z>Y>X |
| B.最高价氧化物对应水化物的酸性:Z>W>X |
| C.四种元素的单质中,Z单质的熔沸点最高 |
| D.X的单质能与H2反应,生成一种弱酸性的物质 |
已知N2(g)+3H2(g)==2NH3(g) △H=-92 kJ·mol-1。且1 mol N≡N键完全断裂时吸收热量946 kJ, 1 mol H-N键形成时放出热量391 kJ,则氢气中1mol H-H键断裂时吸收热量为()
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |