实验室里常用的干燥剂有:①生石灰,②固体氢氧化钠,③变色硅胶[主要成分是二氧化硅,在其中掺入少量的无水氯化钴(CoCl2)作指示剂],④五氧化二磷,⑤无水氯化钙,⑥浓硫酸,⑦碱石灰(主要成分是氢氧化钠、氧化钙)等。
(1)上述物质中,属于纯净物的是__________。
A.①②④ B.②④⑥ C.①②④⑤ D.全部
(2)上述②、④、⑤、⑥四种干燥剂中,其主要化学成分所属的类别依次为______、________、________、______。(填序号)
A.酸 B.碱 C.盐 D.氧化物
(3)硅胶中无水氯化钴(CoCl2)呈蓝色,吸水后变为粉红色的CoCl2•6H2O,该变化过程属于____________(填“物理变化”或“化学变化”)。
(4)下列气体中,能用固体氢氧化钠干燥的是( )
A.CO2 B.HCl C.NO2 D.NH3 E.NO
(5)生石灰常用作食品干燥剂,久置后易失去干燥能力,其原因为_________________ (用化学方程式表示)
(6)上述干燥剂中,仅有浓硫酸为液体干燥剂,下列关于浓硫酸的叙述正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖炭化
B.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C.浓硫酸为液体干燥剂,干燥效率高,能用于干燥所有的气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
某一元弱酸(用HA表示)在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向(填“正”、“逆”)反应方向移动,理由是。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向(填“正”、“逆”、“不移动”)反应方向移动,溶液中c(A-)将(填“增大”、“减小”或“不变”,下同),溶液中c(OH-)将。
(1)0.1mol/L Na2CO3溶液呈(填“酸性”、“碱性”或“中性”),其原因是(用离子方程式表示)
(2)氢氧燃料电池是利用氢能的一种重要方式。请写出氢氧燃料电池(电解质溶液为KOH溶液)的负极的电极反应式;
(3)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示,该温度下水的离子积为;该温度下0.01 mol/L NaOH溶液的pH为。
(4)如图装置,已知两电极上发生的电极反应分别为:
a极:Cu2++2e-= Cu b极:Fe-2e-= Fe2+
该装置中原电解质溶液一定含有;(填序号)
| A.Cu2+ | B.Na+ | C.Fe2+ | D.Ag+ |

(5)硫酸钡在水中存在沉淀溶解平衡:BaSO4(s) Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到mol·L一1。
Ba2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到mol·L一1。
可逆反应:aA(g) + bB(g) 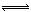 cC(g) + dD(g) ΔH=Q;根据图回答:
cC(g) + dD(g) ΔH=Q;根据图回答:
①压强 P1比P2填(大或小)
② (a +b)比(c +d) 填(大或小)
③温度t1℃比t2℃(高或低)
④ Q值为填(正或负)(正值表示正反应吸热,负值表示正反应放热)
(19分)从樟科植物枝叶提取的精油中含有甲、乙两种成分: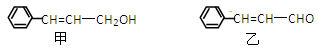
(1) ①甲和乙中含氧官能团的名称分别为和。
②请写出甲的一种能同时满足下列3个条件的同分异构体的结构简式。
a.苯环上有两个不同的取代基
b.能与Br2的CCl4溶液发生加成反应
c.遇FeCl3溶液显呈现紫色
(2) 由甲转化为乙的过程为(已略去无关产物):
写出有关反应的化学方程式:
(3) 反应I的反应类型为,1mol甲最多可与mol H2发生加成反应。
某一无色透明溶液A,焰色反应呈黄色。当向溶液中通入二氧化碳时则得到浑浊液B,B加热到70OC左右,浑浊液变澄清。此时向溶液中加入少量的饱和溴水,立即有白色沉淀C产生。分别写出A、B、C的名称和结构简式:
A:;B:;C:。
完成有关反应的化学方程式: