下列离子组能大量共存的是
| A.Cu2+、Na+、OH- | B.H+、Cl-、CH3COO- |
| C.Fe3+、H+、NO3- | D.K+、Ca2+、CO32- |
四种短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中D形成的两种氧化物都是大气污染物。下列有关判断正确的是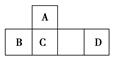
A.简单氢化物的热稳定性:C>A
B.最高价氧化物对应水化物的酸性:D<C
C.B的最高价氧化物的水化物能与C的最高价氧化物的水化物反应
D.A、C、D的含氧酸的钠盐水溶液可能均显碱性
下列判断中,正确的是
| A.已知25 ℃时NH4CN显碱性,则25 ℃时的电离常数K(NH3·H2O)>K(HCN) |
| B.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| C.pH试纸测得新制氯水的pH为4 |
| D.FeCl3溶液和Fe2(SO4)3溶液加热蒸干、灼烧都得到Fe2O3 |
实验法和比较法是研究物质性质的基本方法。以下实验设计中不合理或不严密的是
| A.钠和镁分别与冷水反应,判断钠和镁的金属性强弱 |
| B.测定相同温度下盐酸和醋酸溶液的pH,就可证明盐酸是强酸、醋酸是弱酸 |
| C.铁分别与氯气和硫反应,判断氯气与硫的氧化性强弱 |
| D.测定相同条件下Na2CO3溶液和Na2SO4溶液的pH,判断碳与硫的非金属性强弱 |
室温下,向20.00 mL 1.000 mol·L-1氨水中滴入1.000 mol·L-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法错误的是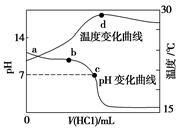
| A.a、d两点的溶液,水的离子积Kw(a)>Kw(d) |
| B.将此氨水稀释,溶液的导电能力减弱 |
| C.c点时消耗盐酸体积V(HCl)<20 mL |
D.室温下,a点的氨水电离常数为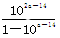 mol·L-1 mol·L-1 |
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)  C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是
| t/s |
0 |
5 |
15 |
25 |
35 |
| n(A)/mol |
1.0 |
0.85 |
0.81 |
0.80 |
0.80 |
A.反应在前5 s的平均速率v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)