“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e- = X + 2H+。下列说法中正确的是
| A.电池内部H+由正极向负极移动 |
| B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH- |
| C.乙醇在正极发生反应,电子经过外电路流向负极 |
| D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
下列叙述正确的是
| A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应 |
| B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2 |
| C.用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 mol NaOH |
| D.镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
根据下列实验现象,所得结论正确的是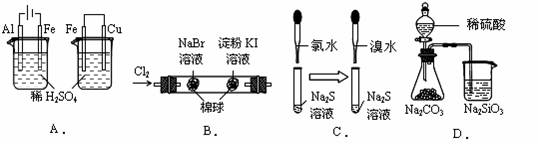
| 实验 |
实验现象 |
结论 |
||
|
下列离子方程式错误的是
| A.向偏铝酸钠溶液中滴加少量盐酸:AlO2—+ H+ + H2O = A1(OH)3↓ |
| B.碳酸氢钠溶液与过量的石灰水:Ca2+ + HCO3-+ OH- = CaCO3↓+ H2O |
| C.向三氯化铁溶液中加入过量铜屑:2Fe3+ + Cu = 2Fe2+ + Cu2+ |
| D.用NaOH溶液吸收少量H2S 气体:OH一+ H2S = HS一+ H2O |
亚氨基羟锂(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
| A.Li2NH中N的化合价是-1 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H—的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
下列各组溶液中,可能大量共存的离子有
| A.含有大量 Ba2+的溶液中: HCO3-、 Ag+、 Fe3+、 Cl- |
| B.滴加甲基橙试液后呈红色的溶液中: Na+、 CO32-、 K+、 AlO2- |
| C.由水电离的c (OH- ) = 10-14mol·L-1的溶液中:CH3COO-、C6H5O-、Na+、K+ |
| D.加入铝粉后产生氢气的溶液中: NH4+、 Na+、 NO3-、Cl- |