已知在25℃时,FeS、CuS的溶度积常数(Ksp)分别为6.3×10-18、1.3×10-36。常温时下列
有关说法正确的是( )
| A.除去工业废水中的Cu2+可以选用FeS作沉淀剂 |
| B.向H2S的饱和溶液中通入少量SO2气体溶液的酸性增强 |
| C.因为H2SO4是强酸,所以反应:CuSO4十H2S=CuS↓+H2SO4不能发生 |
| D.将足量的CuSO4溶解在0.1 mol/L的H2S溶液中,溶液中Cu2+的最大浓度为1.3×10-35mol/L |
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) ="==" 2CO2(g)+2H2O(l)△H1= -870.3 kJ·mol-1
(2)C(s)+O2(g) ="==" CO2(g)△H2= -393.5 kJ·mol-1
(3)H2(g)+O2(g) ="==" H2O(l)△H3= -285.8 kJ·mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的△H为()kJ·mol-1
| A.+488.3 | B.-244.15 | C.-488.3 | D.+244.15 |
某学生欲完成2HCl+2Ag="2AgCl" ↓+H2 ↑反应,设计了下列四个实验,你认为可行的是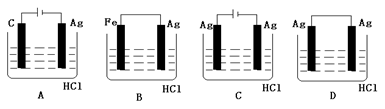
某黄色溶液中可能含有下列离子:K+、NH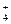 、Fe3+、Ba2+、SO
、Fe3+、Ba2+、SO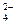 、HCO
、HCO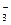 、Cl—、S2—,
、Cl—、S2—,
为检验其成分,先对溶液进行初步分析。下列判断中,不正确的是()
| A.溶液中存在大量Fe3+ | B.溶液中可能存在大量Ba2+ |
| C.溶液中不存在大量HCO3—和S2— | D.溶液可能呈强碱性 |
下列说法中,正确的是()
| A.NH4+与HCO3-均可以水解,故NH4HCO3是弱电解质 |
| B.25℃时,l L pH=3的盐酸与1L pH=11的氨水能恰好中和 |
| C.25℃时,用广泛pH试纸测定出某醋酸溶液的pH=3.5 |
| D.25℃时,pH=14的溶液中,Na+、CO32-、K+、CIO-可以大量共存 |
下列关于砹(85At)及其化合物的说法中,正确的是( )
| A.稳定性:HAt>HCl | B.氧化性:At2>I2 |
| C.At2为分子晶体 | D.NaAt的水溶液呈碱性 |